Пространство вокруг атомного ядра в котором наиболее вероятно нахождение электрона называют
это условная орбита, по которой электроны вращаются вокруг ядра. если я правильно помню.
Остальные ответы
Строго говоря, это некая математическая абстракция. Ну, а если представить образно, то это область пространства вокруг ядра атома, где может находиться электрон. Представь себе воздушный "шарик" диаметром в 1 км, в центре которого находится вишенка (диаметром 1 см) . Это модель увеличенного в 10 000 000 000 000 раз атома водорода в основном состоянии. Вишенка - представляет собой ядро (протон) , а "шарик" - область пространства, в которой может находиться (двигаться) электрон. Этот "шарик" и есть образ 1s орбитали. Причем, мы в принципе не можем определить, в какой именно "точке" находится электрон в данный момент, какова его скорость, какова траектория его движения. Единственно, что мы можем говорить об энергии, которой этот электрон обладает. Отметим, что орбиталь - это вовсе не орбита. Орбита, в наиболее известном (астрономическом) смысле этого слова - это плоская фигура, по которой движется планета вокруг звезды, или спутник вокруг планеты. В этой ситуации мы легко можем определить и местоположение спутника, и его скорость, и рассчитать его координаты в любой момент времени, хоть в будущем, хоть в прошлом. Совершенно иная ситуация с электроном на (или может правильнее в) орбитали. Мы знаем, что он "где-то здесь", но совершенно не можем определить где он сейчас, где был некоторое время назад, и где окажется через некоторое время.
Рафаэль простите, но я вас опять резюмирую:
Атомная орбиталь - это функция распределения электронной плотности, т. е. распределения плотности волновой энергии в заданном объеме на всем удалении от центра - ядра атома
расчет не привожу ибо он громоздкий немного)
AZRAELМастер (2428) 9 лет назад
И да, это не абстракция, а вполне нормальная физическая величина.)
rafael ahmetov Высший разум (122301) Физики и математики возможно согласятся с Вами, но не химики, и тем более основная масса простых людей, не имеющих отношения к наукам. Если это реальная физическая величина, то ее можно пощупать, измерить, ощутить и т.п. Как это можно сделать с "функцией распределения электронной плотности, т.е. распределения плотности волновой энергии в заданном объеме на всем удалении от центра - ядра атома". Слава богу, что расчет не приводите, иначе осталось бы только застрелиться. А вопрос задает обычный школьник. Как ему наглядно объяснить эти Ваши высокие материи? Думаете, после Вашего объяснения школьнику станет понятно (я исключаю таких, как Григорий Перельман), что такое атомная орбиталь и с чем ее едят. А мое объяснение позволяет ему представить, что это такое, и изучать химию дальше. И, я думаю, более 95 % химиков также не понимают Вашего (или других физиков) объяснения, зато им понятно мое, и это их вполне устроит.
Основной принцип выделения орбитали доступно и изящно описал Рафаэль Ахметов. При более формальном походе, орбиталь - функция распредления электронной плотности в атоме или молекуле. Для наглядного представления орбитали выделяют "существенную" часть функции, т. е. вырезают трехмерную фигуру наиболее вероятного нахождения электрона. Квантовая частица с заданной энергией может находиться в любой точке пространства, поэтому для построения такой фигуры нужно задать порог вероятности. Сферически симметричные орбитали изображают в виде шара. Электрон с вероятностью 95% находится внутри шара. Порог вероятности можно сделать немного меньше (90%) или больше (97%), это приведет к незначительному изменению радиуса шара. Таким же способом установили, что p-орбиталь выглядит как гантель.
Орбиталь описанная выше это для единичного атома. В кристалле про орбитали можно говорить для внутренних электронов, исключив электроны проводимости в зоне проводимости и внешние электроны атомного остова. Читаем в интернете. Природа кристаллических структур.
Строение атома. Строение электронных оболочек атомов.
Атом - электронейтральная частица, состоящая из положительно заряженного ядра и отрицательно заряженной электронной оболочки. Ядро находится в центре атома и состоит из положительно заряженных протонов и незаряженных нейтронов, удерживаемых ядерными силами. Ядерное строение атома экспериментально доказал в 1911 г. английский физик Э.Резерфорд.
Число протонов определяет положительный заряд ядра и равно порядковому номеру элемента. Число нейтронов вычисляется как разность атомной массы и порядкового номера элемента. Элементы, имеющие одинаковый заряд ядра (одинаковое число протонов), но разную атомную массу (разное количество нейтронов) называются изотопами. Масса атома в основном сосредоточена в ядре, т.к. ничтожно малой массой электронов можно пренебречь. Атомная масса равна сумме масс всех протонов и всех нейтронов ядра.
Химический элемент - это вид атомов с одинаковым зарядом ядра. В настоящее время известно 118 различных химических элементов.
Все электроны атома образуют его электронную оболочку. Электронная оболочка имеет отрицательный заряд, равный общему количеству электронов. Число электронов в оболочке атома совпадает с числом протонов в ядре и равно порядковому номеру элемента. Электроны в оболочке распределены по электронным слоям согласно запасам энергии (электроны с близкими значениями энергий образуют один электронный слой): электроны с меньшей энергией находятся ближе к ядру, электроны с большей энергией находятся дальше от ядра. Число электронных слоёв (энергетических уровней) совпадает с номером периода, в котором располагается химический элемент.
Различают завершённые и незавершённые энергетические уровни. Уровень считается завершённым, если содержит максимально возможное количество электронов ( первый уровень - 2 электрона, второй уровень - 8 электронов, третий уровень - 18 электронов, четвёртый уровень - 32 электрона и т.д.). Незавершённый уровень содержит меньшее число электронов.
Уровень, максимально удалённый от ядра атома, называется внешним. Электроны, находящиеся на внешнем энергетическом уровне, называются внешними (валентными) электронами. Число электронов на внешнем энергетическом уровне совпадает с номером группы, в которой находится химический элемент. Внешний уровень считается завершённым, если содержит 8 электронов. Завершённым внешним энергетическим уровнем обладают атомы элементов 8А группы (инертные газы гелий, неон, криптон, ксенон, радон).
Область пространства вокруг ядра атома, в которой наиболее вероятно нахождение электрона, называют электронной орбиталью. Орбитали отличаются уровнем энергии и формой. По форме различают s-орбитали (сфера), p-орбитали (объёмная восьмёрка), d-орбитали и f-орбитали. На каждом энергетическом уровне есть свой набор орбиталей: на первом энергетическом уровне - одна s-орбиталь, на втором энергетическом уровне - одна s- и три p-орбитали, на третьем энергетическом уровне - одна s-, три p-, пять d-орбиталей, на четвертом энергетическом уровне одна s-, три p-, пять d-орбиталей и семь f-орбиталей. На каждой орбитале могут располагаться максимально два электрона.
Распределение электронов по орбиталям отражается с помощью электронных формул. Например, для атома магния распределение электронов по энергетическим уровням будет следующим: 2е, 8е, 2е. Данная формула показывает, что 12 электронов атома магния распределены по трём энергетическим уровням: первый уровень завершён и содержит 2 электрона, второй уровень завершён и содержит 8 электронов, третий уровень не завершён, т.к. содержит 2 электрона. Для атома кальция распределение электронов по энергетическим уровням будет следующим: 2е, 8е, 8е, 2е. Данная формула показывает, что 20 электронов кальция распределены по четырём энергетическим уровням: первый уровень завершён и содержит 2 электрона, второй уровень завершён и содержит 8 электронов, третий уровень не завершён, т.к. содержит 8 электронов, четвёртый уровень не завершён, т.к. содержит 2 электрона.
Пространство вокруг атомного ядра в котором наиболее вероятно нахождение электрона называют
УПС, страница пропала с радаров.
Вам может понравиться Все решебники


Александрова
Александрова, Загоровская, Богданов

Лукашик 7-9 класс
Лукашик, Иванова


Мякишев, Буховцев

Главная задача сайта: помогать школьникам и родителям в решении домашнего задания. Кроме того, весь материал совершенствуется, добавляются новые сборники решений.
Пространство вокруг атомного ядра в котором наиболее вероятно нахождение электрона называют

Периодическая система химических элементов
и учение о строении атома
Ключевые слова конспекта по химии для 11 класса: Физический смысл порядкового номера элемента, периода, группы. Валентные электроны. Электронная конфигурация атомов. Закономерности изменения свойств элементов в периодах и группах. Электронные семейства химических элементов.
Периодическая система химических элементов Д. И. Менделеева — это графическое выражение периодического закона. Вы уже знаете, что наиболее известны короткопериодный и длиннопериодный варианты периодической системы химических элементов.
Символика, принятая в периодической системе любой формы, несёт в себе значительную информацию. Напомним:
- заряд атомного ядра каждого химического элемента, который определяется числом протонов в нём, строго соответствует порядковому номеру элемента;
- число нейтронов определяется по разности между массовым числом изотопа и порядковым номером элемента;
- число электронов, составляющих электронную оболочку вокруг атомного ядра, также соответствует порядковому номеру элемента;
- электроны, близкие по запасу энергии, на электронной оболочке образуют слои — энергетические уровни, число которых соответствует номеру периода;
- число электронов во внешнем слое соответствует номеру А–группы.
В образовании химических связей принимают участие электроны внешнего и предвнешнего электронных слоёв. Такие электроны называются валентными.
Особенности строения атомов химических элементов объясняют изменение их свойств и свойств образованных ими веществ в периодах и группах.
По горизонтали, т. е. в периодах, с ростом порядкового номера элементов усиливаются неметаллические свойства и ослабевают металлические. Это обусловлено следующими факторами:
- число электронных слоёв (энергетических уровней) в пределах одного периода не изменяется;
- возрастает число электронов на внешнем слое;
- радиус атомов уменьшается.
Изменения металлических и неметаллических свойств элементов в больших периодах (4—6) происходят медленнее. Это связано с тем, что у атомов элементов Б–групп первые два электрона поступают на внешний энергетический уровень, затем строится предвнешний уровень (с 8 до 18 электронов), и лишь потом снова достраивается внешний уровень до 8 электронов в соответствии с номером группы.
По вертикали, т. е. в группах, с ростом порядкового номера элементов усиливаются металлические свойства и ослабевают неметаллические. Это обусловлено следующими факторами:
- возрастает число электронных слоёв (энергетических уровней), а следовательно, возрастает и радиус атомов;
- число электронов на внешнем слое атома не изменяется.
Частицы микромира, в том числе электроны, обладают двойственной природой, т. е. проявляют одновременно свойства частицы (например, обладают массой) и волны (например, характеризуются длиной волны).
Благодаря этому электрон в атоме может находиться в любой части пространства. Он не имеет траектории движения и можно говорить лишь о вероятности его нахождения в том или ином месте вокруг ядра. Поэтому положение электрона в пространстве отражает принятая в науке модель, называемая электронным облаком, или орбиталью.
Существует несколько типов электронных орбиталей, отличающихся друг от друга по форме. Их обозначают буквами английского алфавита: s, р, d и т. д.
s-Орбиталь имеет сферическую форму. В центре сферы вероятность встретить электрон равна нулю: там находится крошечное ядро атома.
р-Орбиталь напоминает объёмную восьмерку или гантель.

Более сложную форму имеют орбитали d—типа. Большинство из них представляют собой две объёмные восьмёрки со взаимно перпендикулярными осями.
Ещё раз подчеркнём, что электроны, обладающие близкими значениями энергии, образуют единый электронный слой (энергетический уровень).
Каждый энергетический уровень атома имеет строго определённый набор орбиталей:
- 1-й уровень — одна s-орбиталь;
- 2-й уровень — одна s-орбиталь и три р-орбитали;
- 3-й уровень — одна s-орбиталь, три р-орбитали и пять d-орбиталей;
- 4-й уровень — одна s-орбиталь, три р-орбитали, пять d-орбиталей и др.
На каждой орбитали может находиться один электрон (тогда его называют неспаренным электроном) или два электрона (электронная пара или спаренные электроны); кроме того, орбиталь может быть пустой (свободной, или вакантной).
Нетрудно посчитать, что на первом энергетическом уровне может располагаться только два электрона (1 орбиталь • 2 электрона), на втором — восемь электронов (4 орбитали • 2 электрона), на третьем — восемнадцать (9 орбиталей • 2 электрона).
Заполнение электронами уровней и орбиталей происходит согласно принципу наименьшей энергии: сначала заполняется ближайший к ядру первый электронный слой, затем — второй и т. д.
Аналогично происходит и заполнение орбиталей в пределах одного уровня: s-орбиталь выгоднее для электрона, чем р-орбиталь, р-орбиталь предпочтительнее d-орбитали.
Орбитали одного типа (например, р- или d-), расположенные на одном уровне, сначала принимают по одному электрону, затем происходит спаривание электронов.
Например, на втором энергетическом уровне первой заполняется s-орбиталь (её так и обозначают — 2s), потом электроны занимают три р-орбитали (аналогично их обозначают 2р) сначала по одному, и лишь затем происходит заполнение орбиталей вторыми электронами.
Таким образом составляются электронные конфигурации атомов химических элементов. Это условная формула, которая показывает распределение электронов по энергетическим уровням и орбиталям.
У атома водорода 1H (слева внизу указывается порядковый номер элемента, который совпадает с числом электронов в атоме) единственный электрон расположен на единственной s-орбитали единственного энергетического уровня. Электронная конфигурация атома водорода 1s 1 . Надстрочным индексом обозначают число электронов на орбиталях данного типа. Так как у атома гелия 2Не два электрона, его электронная конфигурация — 1s 2 . Первый энергетический уровень заполнен.
Три электрона имеет атом лития 3Li. Его электронная оболочка состоит уже из двух электронных слоёв. Третий электрон за неимением свободного места на первом энергетическом уровне поступает на второй. Из четырёх имеющихся там орбиталей (одной s- и трёх р-) он «выбирает» энергетически более выгодную s-орбиталь 1s 2 2s 1 .
Ниже приведены электронные конфигурации атомов элементов от бериллия до неона. Внимательно проследите, как от элемента к элементу происходит заполнение электронами внешнего (валентного) энергетического уровня.
В зависимости от того, на какую орбиталь поступает последний электрон в атоме химического элемента, все элементы принято делить на четыре электронные семейства:
s-элементы — гелий и элементы I и IIА-групп;
p-элементы — элементы III—VIIIA-групп;
d-элементы — элементы I—VIIIБ-групп, т. е. элементы, расположенные между s- и p-элементами. Их также называют переходными элементами;

f—элементы — лантаноиды (57—71) и актиноиды (89—103).

Рассмотрим, как формируется электронная конфигурация железа — элемента № 26 VIIIБ–группы IV периода. Ядро его атома имеет заряд +26, на электронной оболочке находится 26 электронов: на первом уровне — 2 электрона (на 1s-орбитали), на втором уровне — 8 электронов (2 на 2s-орбитали и 6 на 2р-орбиталях), на внешнем, четвёртом — 2 s-электрона, как у элемента побочной подгруппы, и остальные 14 электронов — на третьем уровне (2 на 3s-орбитали, 6 на 3р-орбиталях и оставшиеся 6 — на 3d-орбиталях). Отсюда и электронная конфигурация:

Конспект урока по химии «Периодическая система химических элементов и учение о строении атома «. В учебных целях использованы цитаты из пособия «Химия. 11 класс : учеб, для общеобразоват. организаций : базовый уровень / О. С. Габриелян, И. Г. Остроумов, С. А. Сладков. — М. : Просвещение». Выберите дальнейшее действие:
Пространство вокруг атомного ядра в котором наиболее вероятно нахождение электрона называют

Что такое атомная орбиталь .
это условная орбита, по которой электроны вращаются вокруг ядра. если я правильно помню.
Остальные ответы
Строго говоря, это некая математическая абстракция. Ну, а если представить образно, то это область пространства вокруг ядра атома, где может находиться электрон. Представь себе воздушный "шарик" диаметром в 1 км, в центре которого находится вишенка (диаметром 1 см) . Это модель увеличенного в 10 000 000 000 000 раз атома водорода в основном состоянии. Вишенка - представляет собой ядро (протон) , а "шарик" - область пространства, в которой может находиться (двигаться) электрон. Этот "шарик" и есть образ 1s орбитали. Причем, мы в принципе не можем определить, в какой именно "точке" находится электрон в данный момент, какова его скорость, какова траектория его движения. Единственно, что мы можем говорить об энергии, которой этот электрон обладает. Отметим, что орбиталь - это вовсе не орбита. Орбита, в наиболее известном (астрономическом) смысле этого слова - это плоская фигура, по которой движется планета вокруг звезды, или спутник вокруг планеты. В этой ситуации мы легко можем определить и местоположение спутника, и его скорость, и рассчитать его координаты в любой момент времени, хоть в будущем, хоть в прошлом. Совершенно иная ситуация с электроном на (или может правильнее в) орбитали. Мы знаем, что он "где-то здесь", но совершенно не можем определить где он сейчас, где был некоторое время назад, и где окажется через некоторое время.
Рафаэль простите, но я вас опять резюмирую:
Атомная орбиталь - это функция распределения электронной плотности, т. е. распределения плотности волновой энергии в заданном объеме на всем удалении от центра - ядра атома
расчет не привожу ибо он громоздкий немного)
AZRAELМастер (2428) 9 лет назад
И да, это не абстракция, а вполне нормальная физическая величина.)
rafael ahmetov Высший разум (122301) Физики и математики возможно согласятся с Вами, но не химики, и тем более основная масса простых людей, не имеющих отношения к наукам. Если это реальная физическая величина, то ее можно пощупать, измерить, ощутить и т.п. Как это можно сделать с "функцией распределения электронной плотности, т.е. распределения плотности волновой энергии в заданном объеме на всем удалении от центра - ядра атома". Слава богу, что расчет не приводите, иначе осталось бы только застрелиться. А вопрос задает обычный школьник. Как ему наглядно объяснить эти Ваши высокие материи? Думаете, после Вашего объяснения школьнику станет понятно (я исключаю таких, как Григорий Перельман), что такое атомная орбиталь и с чем ее едят. А мое объяснение позволяет ему представить, что это такое, и изучать химию дальше. И, я думаю, более 95 % химиков также не понимают Вашего (или других физиков) объяснения, зато им понятно мое, и это их вполне устроит.
Основной принцип выделения орбитали доступно и изящно описал Рафаэль Ахметов. При более формальном походе, орбиталь - функция распредления электронной плотности в атоме или молекуле. Для наглядного представления орбитали выделяют "существенную" часть функции, т. е. вырезают трехмерную фигуру наиболее вероятного нахождения электрона. Квантовая частица с заданной энергией может находиться в любой точке пространства, поэтому для построения такой фигуры нужно задать порог вероятности. Сферически симметричные орбитали изображают в виде шара. Электрон с вероятностью 95% находится внутри шара. Порог вероятности можно сделать немного меньше (90%) или больше (97%), это приведет к незначительному изменению радиуса шара. Таким же способом установили, что p-орбиталь выглядит как гантель.
Орбиталь описанная выше это для единичного атома. В кристалле про орбитали можно говорить для внутренних электронов, исключив электроны проводимости в зоне проводимости и внешние электроны атомного остова. Читаем в интернете. Природа кристаллических структур.
2. Что такое электронное облако и как это понятие соотносится с понятием «орбиталь»?
Орбиталь — пространство вокруг атомного ядра, в котором наиболее вероятно нахождение электрона, совокупность различных положений электрона в этом пространстве называется электронным облаком.
Источник:

Решебник по химии за 11 класс (О.С.Габриелян, 2002 год),
задача №2
к главе «Глава 1. Строение атома. §2. Состояние электронов в атоме».
1. Состояние электрона в атоме
Электрон в атоме находится в постоянном движении вокруг ядра.
Для описания состояния электрона оценивается вероятность его нахождения в околоядерной области пространства и используются понятия « электронное облако », « электронная орбиталь ».
Электронное облако — модель движения электрона в атоме; область пространства, в каждой точке которой может находиться данный электрон.
Рис. \(1\). Электронное облако
Электронная орбиталь — область околоядерного пространства, в которой вероятность нахождения электрона более \(90\) %.
Электронные орбитали имеют разную форму . В атоме водорода орбиталь единственного электрона имеет форму шара. Это \(s\) - орбиталь .
Рис. \(2\). \(s\)-орбиталь
В атомах других элементов электроны могут находиться на гантелеобразных \(p\) - орбиталях .
Рис. \(3\). \(p\) -орбиталь
Известны и более сложные по форме орбитали.
Электронные орбитали различаются размерами . Размер зависит от энергии электрона. Чем больше энергия электрона, тем больше по размеру его орбиталь, и тем дальше он находится от ядра.
Обрати внимание!
Чем дальше электрон от ядра, тем больше его энергия и слабее связь с ядром.
На одной орбитали может содержаться не более двух электронов . Два электрона на одной орбитали называют спаренными. Если на орбитали находится один электрон, то он неспаренный.
Подготовка к ОГЭ по химии. 9 класс
1. Состояние электронов в атоме. Электронные орбитали
Электрон — это очень маленькая частица, которая движется с огромной скоростью. Для описания движения электрона нельзя применить законы механики. Когда характеризуют движение электрона, то говорят о вероятности его нахождения в той или иной области пространства.
Электроны занимают в атоме пространство вокруг ядра и перемещаются в нём с большой скоростью в разных направлениях. Говорят, что они образуют электронное облако.
Пространство, занятое электронами, огромно по сравнению с объёмом ядра. Но это не означает, что каждый электрон может находиться в любой точке пространства. Оказалось, что электроны передвигаются только в ограниченных объёмах. Эти объёмы назвали электронными слоями или энергетическими уровнями. Число таких уровней совпадает с номером периода, в котором химический элемент располагается в периодической системе. На каждом уровне может разместиться только определённое количество электронов.
Для любого электрона можно выделить область пространства, где он бывает с вероятностью не менее \(90\) %. Такую область пространства называют атомной или электронной орбиталью. Орбитали различаются формой и размерами.
Орбитали различной формы обозначают буквами: \(s\), \(p\), \(d\), \(f\). Так, \(s\)-орбиталь шарообразная, а \(p\)-орбиталь напоминает объёмную восьмёрку или гантель. У \(d\)- и \(f\)-орбиталей более сложная форма.
Рис. \(1\). \(s\)-орбиталь
Рис. \(2\). \(p\)-орбиталь
На одной орбитали не может быть более двух электронов. Если там два электрона, то они называются спаренными.
Энергетические уровни принято нумеровать, начиная с самого близкого к ядру. Номер обозначают числом (\(1\), \(2\), \(3\)… \(7\)).
На энергетических уровнях выделяют подуровни, образованные орбиталями одного вида. На первом энергетическом уровне всего один подуровень, на втором — два и т. д. Подуровни обозначают теми же буквами, что и орбитали: \(s\), \(p\), \(d\), \(f\).
Число орбиталей на подуровнях: \(s\)-орбиталь — \(1\), \(p\)-орбителей — \(3\), \(d\)-орбиталей — \(5\), а \(f\)-орбиталей — \(7\).
Удобно показывать распределение электронов по орбиталям с помощью графических схем. Орбиталь в таких схемах принято рисовать в виде квадрата, а электрон — в виде стрелки. Орбитали первых четырёх энергетических уровней можно показать следующим образом.
Современные представления о строении атома
Элемент ЕГЭ: 1.1 Современные представления о строении атома. 1.1.1 Строение электронных оболочек атомов элементов первых четырех периодов: s-, р- и d-элементы. Электронная конфигурация атома. Основное и возбуждённое состояние атомов.
Содержание (быстрый переход): СкрытьСовременные представления о строении атома

Атом – химически неделимая электронейтральная частица, которая состоит из положительно заряженного ядра и движущихся вокруг него отрицательно заряженных электронов.
Атомы не имеют заряда (нейтральны). Если атом присоединяет один или несколько электронов, он приобретает отрицательный заряд и превращается в анион. Если атом теряет один или несколько электронов, он приобретает положительный заряд и превращается в катион. Заряд иона указывают арабской цифрой и знаком после символа атома.
Состав ядра: А = Z + N, где А — массовое число; Z — протонное число (число протонов); N — число нейтронов.
Элементарные частицы
Порядковый номер элемента в периодической системе:
- Заряд ядра атома
- Число протонов в ядре атома
- Число электронов в атоме

Нуклиды – разновидности атомов с фиксированным массовым числом А, числом протонов Z и нейтронов N в ядре.

Основные положения квантовой теории строения атома:
- Дискретность энергии электрона
- Двойственная (корпускулярно-волновая) природа электрона
- Невозможность определения траектории электрона (принцип неопределенности)
Относительная атомная масса элемента (Ar)
Физическая величина, показывающая, во сколько раз средняя масса атомов данного элемента больше 1/12 части массы изотопа углерода 12 С.

Атомные орбитали
Орбиталь — пространство вокруг ядра, в котором нахождение электрона наиболее вероятно (вероятность более 90%)

Порядок заполнения орбиталей в основном состоянии
1) Принцип наименьшей энергии. Электроны занимают в первую очередь орбитали, имеющие наименьшую энергию.


2) Принцип Паули. На каждой орбитали могут находиться не более двух электронов, причём спины их противоположны.
Спин электрона — свойство электрона, характеризующее его способность взаимодействовать с магнитным полем. Может принимать два значения (положительное и отрицательное).

Последовательность заполнения орбиталей электронами в основном состоянии:
Энергетические уровни и подуровни

Элементы, у которых идет заполнение s-подуровня, называют s-элементами.
Элементы, у которых заполняется р-подуровень, называют р-элементами.
Элементы, у которых заполняется d-подуровень, называют d-элементами.
Элементы, у которых заполняется f-подуровень, называют f-элементами.
Распределение электронов в атоме по энергетическим уровням (электронным слоям) и подуровням
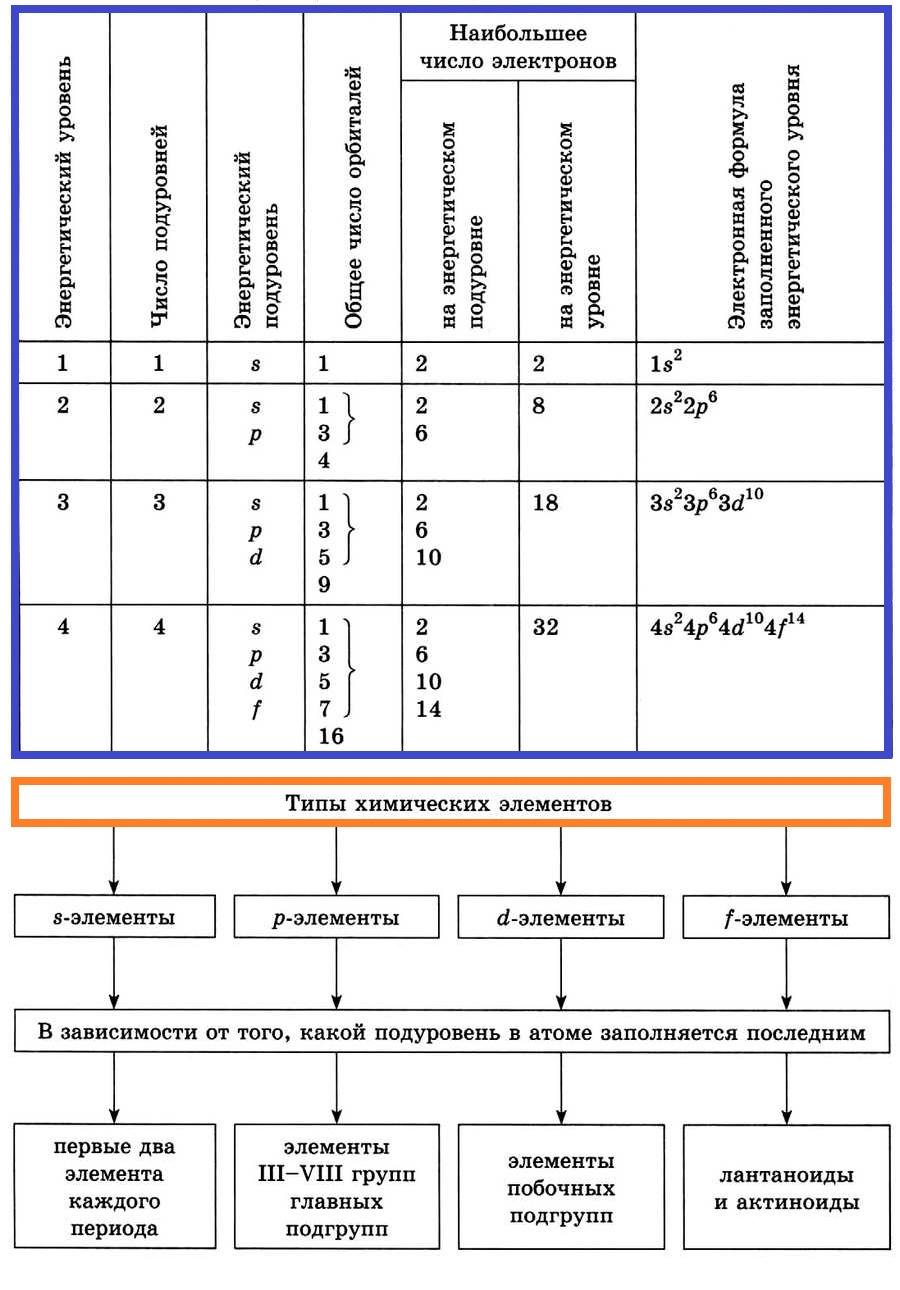
Электроны, относящиеся к последнему энергетическому уровню, называют внешними (валентными) электронами.
Строение электронных оболочек атомов первых четырёх периодов
Распределение электронов по орбиталям атома называют электронной конфигурацией атома, или электронной формулой.
Строение элементов первого периода

Строение элементов второго периода

Строение элементов третьего периода

Строение элементов четвёртого периода

Электронные конфигурации d 5 и d 10 обладают повышенной устойчивостью, поэтому в атомах хрома и меди наблюдается «перескок» электрона с 4s-подуровня на 3d-подуровень («провал электрона»).
Основное и возбуждённое состояние атомов
Наиболее устойчивое состояние атома, в котором энергия его электронной оболочки минимальна, называется основным состоянием атома. Любые другие состояния атома называют возбужденными состояниями.

Для возможности перехода атома в возбуждённое состояние необходимо выполнение одновременно двух условий:
- наличие спаренных электронов;
- наличие вакантных орбиталей.
Таблица «Современные представления о строении атома. Кратко»

(с) В учебных целях использованы цитаты из пособий: «Химия / Н. Э. Варавва, О. В. Мешкова. — Москва, Эксмо (ЕГЭ. Экспресс-подготовка)» и «Химия : Новый полный справочник для подготовки к ЕГЭ / Е.В. Савинкина. — Москва, Издательство АСТ».
Вы смотрели Справочник по химии «Современные представления о строении атома». Выберите дальнейшее действие:
Читайте также:


