Сплав в котором атомы растворенного элемента распределяются в решетке растворителя имеет структуру
Твердыми растворами называют однородные кристаллические фазы переменного состава.
Твердые растворы определенной структуры представляют собой одну кристаллическую фазу, состав которой в определенных пределах (в так называемой области гомогенности) может изменяться без появления новых фаз. Различают несколько типов твердых растворов (рис. 10). Два типа -твердые растворы замещения (твердые растворы I рода) и твердые растворы внедрения- (твердые растворы II рода) образуются при внедрении в решетку («растворении» в решетке) какого-либо кристаллического соединения атомов или ионов другого соединения. Причем при образовании твердых растворов замещения «собственные» атомы основного вещества (матрицы) замещаются на внедряющиеся атомы, а при образовании твердых растворов внедрения эти атомы располагаются в междоузлиях решетки матричного вещества. Третий тип твердых растворов не связан с внедрением в решетку посторонних атомов или ионов, а обусловлен отклонением в определенных пределах состава данного соединения от его стехиометрического состава. Такие твердые растворы называются дефектами нестехиометрии (для некоторых из них иногда используют название твердые растворы вычитания).

Рис. 10. Типы твердых растворов: а — замещения; б — внедрения; в — вычитания
Твердые растворы не являются каким-то исключительным явлением. Наоборот, это весьма характерное состояние реальных веществ, поскольку не существует веществ абсолютно нерастворимых друг в друге в твердом состоянии. Точно так же практически не существует соединений с координационными решетками, состав которых всегда точно соответствовал бы стехиометрическому составу.
Твердые растворы замещения. Если атомы или ионы одного вещества, внедряясь в решетку другого вещества, замещают его собственные атомы или ионы в узлах решетки, возникают твердые растворы замещения.
Твердыми растворами замещения называются такие растворы, которые образуются в результате статистического замещения атомов или ионов в структуре какого-либо кристаллического вещества (растворители или матрицы) атомами или ионами другого (растворенного) вещества, занимающими в результате этого регулярные узлы кристаллической решетки.
Твердые растворы замещения (рис. 10, а)часто называют также смешанными кристаллами и изоморфными смесями, а процесс образования твердых растворов замещения называют изоморфным замещением.
При образовании твердых растворов замещения в принципе замещать друг друга могут как катионы, так и анионы.
Некоторые вещества могут образовывать твердые растворы весьма легко, например при их совместной кристаллизации из растворов. Однако чаще всего, например в силикатных системах, для образования твердых растворов требуется значительная энергия активации, поэтому их возникновение связано с различными термическими процессами (нагреванием до высокой температуры, плавлением с последующей кристаллизацией, гидротермальными процессами).
Способность атомов или ионов входить в структуру другого вещества определяется, с одной стороны, индивидуальными свойствами атомов или ионов (размер, заряд, электронное строение) и, с другой стороны, особенностями кристаллической структуры веществ, образующих твердые растворы.

Твердые растворы внедрения.Атомы или ионы одного вещества могут не замещать атомы или ионы другого, а располагаться в промежутках между ними (рис. 10, б). В этом случае возникают твердые растворы внедрения.
Твердыми растворами внедрения называются такие растворы, которые образуются в результате внедрения атомов или ионов одного вещества в свободные промежутки (междоузлия) кристаллической решетки другого вещества - растворителя.
Типичными представителями подобных твердых растворов являются так называемые фазы внедрения - соединения, образующиеся при внедрении в междоузлия плотноупакованных решеток переходных металлов атомов неметаллов, например водорода (гидриды), азота (нитриды), углерода (карбиды) и т. д. Конкретным примером фазы внедрения является сталь - твердый раствор внедрения углерода в решетке железа. Фазы внедрения переменного состава часто имеют значительные области гомогенности.
Следует отметить, что твердые растворы внедрения в отличие от твердых растворов замещения могут быть только ограниченными, поскольку обычно при определенной концентрации растворяющегося компонента напряжения в решетке за счет внедряющихся атомов становятся столь значительными, что существование устойчивого твердого раствора мало вероятно.
Многие свойства фаз внедрения, такие, например, как высокая твердость и тугоплавкость, превышающие эти характеристики у металлов, обусловлены прочной ковалентной связью атомов металла и неметалла с участием -электронов. Наличие металлической межатомной связи в подобных фазах объясняет их металлический блеск, высокую электрическую проводимость, способность некоторых из них вблизи температуры абсолютного нуля переходить в сверхпроводящее состояние.
Дефекты нестехиометрии.В настоящее время установлено, что практически все химические соединения в твердом состоянии с координационными (атомными, ионными или металлическими) решетками имеют переменный состав, т. е. обнаруживают в той или иной степени отклонения от стехиометрического состава, выражаемого формулой этого соединения. Область составов, лежащих внутри граничных значений нарушения стехиометрического состава, называется областью гомогенности или областью нестехиометрии. Постоянный и неизменный химический состав, соответствующий стехиометрической формуле, могут иметь только соединения с молекулярными решетками.
Отклонения от стехиометрии являются следствием дефектов решетки (дефектов нестехиометрии), которые могут проявляться в виде избытка (по сравнению со стехиометрическим) катионов вследствие анионных вакансий (КС1, ТhO2, СеO2, РbО, ТiO и т. д.) или в результате присутствия катионов в междоузлиях решетки (ZnО, СdO и т. д.), избытка анионов из-за наличия в решетке катионных вакансий (FеО, NiO, FеS, ТiO и т. д.) или присутствия анионов в междоузлиях (UO2 и т. д.). Возможны и комбинации указанных видов дефектов в одном и том же соединении.
Поскольку нестехиометрические соединения в пределах области гомогенности представляют собой одну фазу переменного состава, их можно квалифицировать как твердые растворы. Если нарушения стехиометрии вызваны наличием в решетке катионных или анионных вакансий, т. е. при недостатке атомов в соответствующей катионной или анионной подрешетке, то такие твердые растворы иногда называют твердыми растворами вычитания (рис. 10, е), если же эти нарушения вызваны избытком катионов или анионов в междоузлиях, то такие твердые растворы можно рассматривать как твердые растворы внедрения собственных катионов или анионов данного соединения в его кристаллическую решетку.
Возникновение нестехиометрических соединений является следствием термодинамически неизбежного обмена веществом данной кристаллической фазы с окружающей средой, т. е. другими фазами (газообразными, жидкими или твердыми). Степень отклонения от стехиометрии зависит прежде всего от физико-химической природы самого соединения и для разных соединений различна. Иногда область гомогенности (область нестехиометрии) бывает весьма узкой и ее обнаружение ограничивается недостаточной чувствительностью применяемых методов исследования. Такие соединения можно условно рассматривать как соединения, не имеющие области гомогенности, т. е. соединения постоянного состава. Их иногда называют линейными фазами, поскольку на диаграмме состояния состав этих соединений отображается вертикальной линией - ординатой соответствующего состава.
Контрольная работа 1 Вариант 18
Что представляют собой твердые растворы замещения и внедрения? Приведите примеры.
Твердыми растворами называют фазы, в которых один из компонентов сплава сохраняет свою кристаллическую решетку, а атомы других (или другого) компонентов располагаются в решетке первого компонента (растворителя), изменяя ее размеры (периоды).
Таким образом, твердый раствор, состоящий из двух или нескольких компонентов, имеет один тип решетки и представляет собой одну фазу.
Существуют твердые растворы внедрения и твердые растворы замещения.
При образовании твердых растворов внедрения атомы растворенного компонента B размещаются между атомами растворителя A в его кристаллической решетке. При образовании твердых растворов замещения атомы растворенного компонента B замещают часть атомов растворителя (компонент A) в его кристаллической решетке.
Поскольку размеры растворенных атомов отличаются от размеров атомов растворителя, то образование твердого раствора сопровождается искажением кристаллической решетки растворителя.
а – атом растворенного компонента больше атома растворителя
б – атом растворенного компонента меньше атома растворителя
Твердые растворы замещения могут быть с ограниченной и неограниченной растворимостью. В твердых растворах с ограниченной растворимостью концентрация растворенного компонента возможна до определенных пределов.
В твердых растворах с неограниченной растворимостью возможна любая концентрация растворенного компонента (от 0 до 100%). Твердые растворы с неограниченной растворимостью образуются при соблюдении следующих условий: 1) у компонентов должны быть однотипные кристаллические решетки; 2) различие в атомных радиусах компонентов не должно превышать для сплавов на основе железа 9%, а для сплавов на основе меди 15%; 3) компоненты должны обладать близостью физико-химических свойств. Однако соблюдение этих свойств не всегда приводит к образованию твердых растворов замещения с неограниченной растворимостью. На практике, как правило, образуются твердые растворы с ограниченной растворимостью.
Твердые растворы внедрения могут быть только с ограниченной концентрации, поскольку число пор в решетке ограничено, а атомы основного компонента сохраняются в узлах решетки.
Твердые растворы замещения с неограниченной растворимостью на основе компонентов: Ag и Au, Ni и Cu, Mo и W, V и Ti, и т.д.
Твердые растворы замещения с ограниченной растворимостью на основе компонентов: Al и Cu, Cu и Zn, и т.д.
Твердые растворы внедрения: при растворении в металлах неметаллических элементов, как углерод, бор, азот и кислород. Например: Fe и С.
Как и почему при холодной пластической деформации изменяются свойства металлов?
Холодной деформацией называют такую, которую проводят при температуре ниже температуры рекристаллизации. Поэтому холодная деформация сопровождается упрочнением (наклепом) металла.
Форма заготовки при обработке давлением изменяется под действием внешних сил вследствие пластической деформации каждого кристаллита в соответствии со схемой главных деформаций. Основное изменение формы кристаллитов состоит в том, что они вытягиваются в направлении главной деформации растяжения (например, в направлении прокатки или волочения). С повышением степени холодной деформации зерна все более вытягиваются и структура становится волокнистой.
Упрочнение металла в процессе пластической деформации (наклеп) объясняется увеличением числа дефектов кристаллического строения (дислокаций, вакансий, межузельных атомов). Повышение плотности дефектов кристаллического строения затрудняет движение отдельных новых дислокаций, а следовательно, повышает сопротивление деформации и уменьшает пластичность. Наибольшее значение имеет увеличение плотности дислокаций, так как возникающее при этом между ними взаимодействие тормозит дальнейшее их перемещение.
С увеличением степени холодной деформации показатели сопротивления деформированию (временное сопротивление, предел текучести и твердости) возрастают, а показатели пластичности (относительное удлинение и сужение) падают.
С помощью диаграммы состояния железо-карбид железа и графика зависимости твердости от температуры отпуска назначьте режим термической обработки (температуру закалки, охлаждающую среду и температуру отпуска) изделий из стали 50, которые должны иметь твердость 230…250 НВ. Опишите микроструктуру и свойства стали 50 после термической обработки.
Критические точки для Ст50: АС1=725ºС, АС3=760ºС.
При нагреве до 700ºС в стали 50 не происходят аллотропические превращения и мы имеем ту же структуру – перлит + феррит, быстро охлаждая (т.к. закалка), имеем также после охлаждения перлит + феррит с теми же механическими свойствами (примерно), что и в исходном состоянии до нагрева под закалку.
Если доэвтектоидную сталь нагреть выше Ас1, но ниже Ас3, то в ее структуре после закалки наряду с мартенситом будут участки феррита. Присутствие феррита как мягкой составляющей снижает твердость стали после закалки. Такая закалка называется неполной. Она обеспечивает хорошие механические свойства и штампуемость. При температуре нагрева структура – аустенит + феррит. При охлаждении со скоростью выше критической происходит мартенситное превращение: γ->М. В результате получаем структуру феррит + мартенсит.
Оптимальный режим нагрева под закалку для доэвтектоидных сталей (%С<0,8%) составляет АС3+(30÷50º), т.е. для Ст50 – 800-820ºС. При этом после закалки имеем мелкое зерно, обеспечивающее наилучшие механические свойства стали 50.
Нагрев и выдержка стали 50 выше температуры 820ºС перед закалкой приводит к росту зерна и ухудшению механических свойств стали после термической обработки. Крупнозернистая структура вызывает повышенную хрупкость стали.
Для обеспечения скорости охлаждения выше критической в качестве среды охлаждения выбираем воду. Структура стали 50 при температуре нагрева под закалку – аустенит, после охлаждения со скоростью выше критической – мартенсит.
Отпуском называется нагрев стали до температуры ниже Ас1, выдержка при заданной температуре и последующее охлаждение с заданной скорость (обычно на воздухе). Отпуск является конечной операцией термической обработки, проводится после закалки для уменьшения внутренних напряжений и получения более равновесной структуры. Напряжения в закаленных изделиях снимаются тем полнее, чем выше температура отпуска.
Для получения твердости 230…250 НВ при диаметре заготовки 20 мм отпуск стали 50 необходимо проводить при температуре 500ºС. Среда охлаждения – вода. При высокотемпературном отпуске образуется структура, которая называется сорбит отпуска. Сорбит отпуска состоит из ферритной основы, пронизанной частицами цементита.
Свойства стали 50 после термической обработки: σт=680-780 МПа, σв=870-970 МПа, δ=13-11%, ψ=61-57%, ан=120-80, НВ=230-250.
Сталь 40 подверглась закалке от температур 760 и 840 ºС. Используя диаграмму состояния железо-цементит, укажите выбранные температуры нагрева и опишите превращения, которые произошли при двух режимах закалки. Какому режиму следует отдать предпочтение и почему?
Закалка доэвтектоидной стали заключается в нагреве стали до температуры выше критической (Ас3), в выдержке и последующем охлаждении со скоростью, превышающей критическую.
Температура точки Ас3 для стали 40 составляет 790°С.
Если доэвтектоидную сталь нагреть выше Ас1, но ниже Ас3, то в ее структуре после закалки наряду с мартенситом будут участки феррита. Присутствие феррита как мягкой составляющей снижает твердость стали после закалки. При нагреве до температуры 760°С (ниже точки Ас3) структура стали 40 – аустенит + феррит, после охлаждения со скоростью выше критической структура стали – мартенсит + феррит.
Рисунок 5 – Фрагмент диаграммы железо-углерод
Аустенит неоднороден по химическому составу. В тех местах, где были пластинки цементита, аустенит богаче углеродом, а где пластинки феррита – беднее. Поэтому при термической обработке для выравнивания химического состава зерен аустенита сталь нагревают немного выше критической точки Ас3 (на 30-50°С) и выдерживают некоторое время при этой температуре. Процесс аустенизации идет тем быстрее, чем выше превышение фактической температуры нагрева под закалку относительно температуры Ас3. Доэвтектоидные стали для полной закалки следует нагревать до температуры на 30-50°С выше Ас3. Температура нагрева стали 40 под полную закалку, таким образом, составляет 820-840°С. Структура стали 40 при температуре нагрева под закалку – аустенит, после охлаждения со скоростью выше критической – мартенсит.
Если нагреть выше этой температуры мелкие зерна аустенита начинают соединяться между собой и чем выше температура нагрева, тем интенсивнее увеличиваются размеры. Крупнозернистая структура ухудшает механические свойства стали.
Поэтому следует отдать предпочтение закалке от температуры 840 ºС.
Контрольная работа 1 Вариант 5
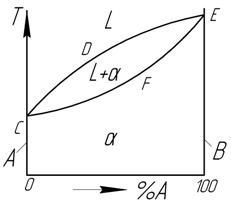
По степеням растворимости компонентов различают твердые растворы:
– с неограниченной растворимостью компонентов;
– с ограниченной растворимостью компонентов.
При неограниченной растворимости компонентов кристаллическая решетка компонента растворителя по мере увеличения концентрации растворенного компонента плавно переходит в кристаллическую решетку растворенного компонента.
Рисунок 1 – Диаграмма состояний сплавов с неограниченной растворимостью компонентов
В этих сплавах компоненты в твердом состоянии неограниченно растворяются друг в друге; при этом образуется взаимный твердый раствор α. В данном случае чистые компоненты А и В не являются самостоятельными фазами системы, – они представляют собой предельные частные случаи твердого раствора α…
Однофазные области на диаграмме:
1) жидкость L – выше линии ликвидус CDE;
2) тв. раствор α – ниже линии солидус CFE.
Кристаллизация сплавов этого типа начинается на линии СDE и заканчивается на линии CFE постепенным переходом жидкого раствора L в твердые кристаллы α. Структуры всех сплавов этого типа при комнатной температура подобны: однородные кристаллы твердого раствора α, являющиеся единственной структурной составляющей в сплавах этого типа.
Для образования растворов с неограниченной растворимостью необходимо выполнение следующих условий:
– изоморфность (однотипность) кристаллических решеток компонентов;
– близость атомных радиусов компонентов R, которые не должны отличаться более чем на 8…13 %;
– близость физико-химических свойств подобных по строению валентных оболочек атомов.
Например, неограниченно растворяются в твердом состоянии следующие металлы с ГЦК-решеткой: Ag и Au (R=0,2%), Ni и Cu (R=2,7%), Ni и Rd (R=10,5%) и др., а также металлы с ОЦК решеткой: Mo и W (R=9,9%), V и Ti (R=2,0%). Такие металлы, как Na, Ca, R, Pb, Sr и другие, имеющие большой атомный диаметр, в Feγ, Cu, Ni нерастворимы.
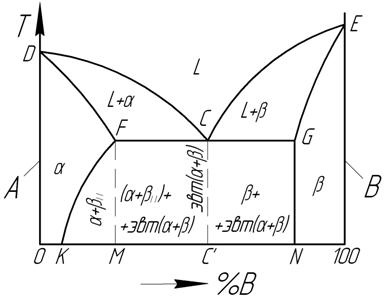
Твердые растворы внедрения могут быть только ограниченной концентрации, поскольку число пор в решетке ограничено, а атомы основного компонента сохраняются в узлах решетки.
Сплавы с ограниченной растворимостью компонентов
В этих сплавах в твердом состоянии компоненты растворяются друг в друге с образованием твердых растворов α (В в А) и β (А в В), между которыми образуется эвтектика эвт(α+β).
Однофазные области на диаграмме:
1) жидкость L – выше линии ликвидус DCE;
2) тв. раствор α – область 0DFK0;
3) тв. раствор β – область NGE-100-N.
Рисунок 2 – Диаграмма состояний сплавов с ограниченной растворимостью
Линии верхней части диаграммы – образование кристаллов твердых растворов α и β.
Однако, в отличии от предыдущей диаграммы, предельное содержание компонента B в α ограничено: оно не может быть более М% В (в точке F). Аналогично, предельное содержание А в β не может быть более (100-N)% A (в точке G). То есть, в данном случае при растворении компонентов друг в друге образуются так называемые ограниченные твердые растворы α и β.
В общем случае, при снижении температуры после достижения предела растворимости (т.е. ниже уровня FCG) предельное содержание растворенного компонента в твердом растворе может изменяться. Эта зависимость предела растворимости от температуры твердого раствора α показана линией FK, а для β – линией GN. Видно, что с уменьшением температуры возможное содержание В в α уменьшается (от М% В до К% В при 0ºС). Поэтому, при охлаждении сплавов, содержащих от К % В до М % В, ниже линии FK из них будет выделяться оказавшаяся избыточная часть компонента В в виде кристаллов вторичного βII (доказывается правилом отрезков), и в области KFMK сплавы будут иметь фазовый состав α+βII.
В частном случае, показанном линией GN, предел растворимости А в β не зависит от температуры и кристаллы твердого раствора β, образовавшиеся на линии GE, будут охлаждаться до комнатной температуры без каких-либо внутренних изменений.
В средней части диаграммы сплавы кристаллизуются с образованием эвтектики на линии FCG. Эвтектика содержит С/% В и кристаллизуется по реакции: Lэвт–>эвт(α+β). В доэвтектических сплавах этой области в конечной структуре сплава будут присутствовать кроме эвтектики кристаллы (α+βII), а в заэвтектических – кристаллы β.
Структурные составляющие сплавов:
1) кристаллы α – область 0DFK0;
2) кристаллы β – область NGE-100-N;
3) кристаллы эвтектики эвт(α+β) – линия СС/.
Опишите сущность явления наклепа и примеры его практического использования.
Наклеп – изменение структуры и свойств металлического материала, вызванное пластической деформацией. Наклеп снижает пластичность и ударную вязкость, но увеличивает предел пропорциональность, предел текучести и твердость. Наклеп снижает сопротивление материала деформации противоположного знака. При поверхностном наклепе изменяется остаточное напряженное состояние в материале и повышается его усталостная прочность. Наклеп возникает при обработке металлов давлением (прокатка, волочение, ковка, штамповка), резанием, при обкатке роликами, при специальной обработке дробью.
Упрочнение металла в процессе пластической деформации (наклеп) объясняется увеличением числа дефектов кристаллического строения (дислокаций, вакансий, межузельных атомов). Повышение плотности дефектов кристаллического строения затрудняет движение отдельных новых дислокаций, а, следовательно, повышает сопротивление деформации и уменьшает пластичность. Наибольшее значение имеет увеличение плотности дислокаций, так как возникающее при этом между ними взаимодействие тормозит дальнейшее их перемещение.
Повышение долговечности деталей машин методом поверхностного пластического деформирования (ППД) или поверхностного наклепа широко используется в промышленности для повышения сопротивляемости малоцикловой и многоцикловой усталости деталей машин. На рисунке 3 приведены схемы различных ППД.
а – дробеструйная упрочняющая обработка; б – чистовая обработка – обкатываем шаром; в – обработка дорнованием; г – центробежно-шариковая чистовая обработка; д – обработка чеканкой; е – упрочнение взрывом; ж — упрочнение виброобкатыванием; з – алмазное выглаживание
Рисунок 3 – Схемы поверхностной пластической деформации
Поверхностное упрочнение достигается:
1) дробеструйным наклепом за счет кинетической энергии потока чугунной или стальной дроби; поток дроби на обрабатываемую поверхность направляется или скоростным потоком воздуха, или роторным дробеметом (рис. 3, а);
2) центробежно-шариковым наклепом за счет кинетической энергии стальных шариков (роликов), расположенных на периферии вращающегося диска; при вращении диска под действием центробежной силы шарики отбрасываются к периферии обода, взаимодействуют с обрабатываемой поверхностью и отбрасываются в глубь гнезда;
3) накатываем стальным шариком или роликом (60 HRC) (рис. 3, б); передача нагрузки на ролик может быть с жестким и упругим контактом между инструментом и обрабатываемой поверхностью;
4) алмазным выглаживанием оправкой с впаенным в рабочей части алмазом (рис. 3, з); оно позволяет получать блестящую поверхность с малой шероховатостью.
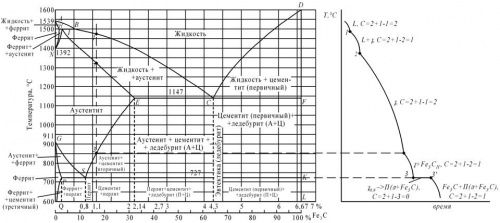
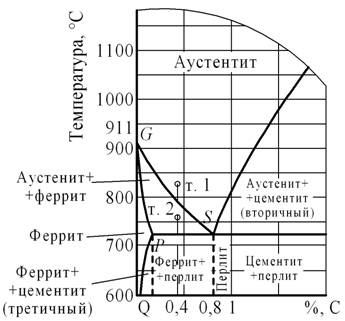
Вычертите диаграмму состояния железо – карбид железа, укажите структурные составляющие во всех областях диаграммы, опишите превращения и постройте кривую охлаждения (с применением правила фаз) для сплава, содержащего 1,1% С. Какова структура этого сплава при комнатной температуре и как такой сплав называется?
Первичная кристаллизация сплавов системы железо-углерод начинается по достижении температур, соответствующих линии ABCD (линии ликвидус), и заканчивается при температурах, образующих линию AHJECF (линию солидус).
При кристаллизации сплавов по линии АВ из жидкого раствора выделяются кристаллы твердого раствора углерода в α-железе (δ-раствор). Процесс кристаллизации сплавов с содержанием углерода до 0,1 % заканчивается по линии АН с образованием α (δ)-твердого раствора. На линии HJB протекает перитектическое превращение, в результате которого образуется твердый раствор углерода в γ-железе, т. е. аустенит. Процесс первичной кристаллизации сталей заканчивается по линии AHJE.
При температурах, соответствующих линии ВС, из жидкого раствора кристаллизуется аустенит. В сплавах, содержащих от 4,3 % до 6,67 % углерода, при температурах, соответствующих линии CD, начинают выделяться кристаллы цементита первичного. Цементит, кристаллизующийся из жидкой фазы, называется первичным. B точке С при температуре 1147°С и концентрации углерода в жидком растворе 4,3 % образуется эвтектика, которая называется ледебуритом. Эвтектическое превращение с образованием ледебурита можно записать формулой ЖР4,3Л[А2,14+Ц6,67]. Процесс первичной кристаллизации чугунов заканчивается по линии ECF образованием ледебурита.
Таким образом, структура чугунов ниже 1147°С будет: доэвтектических – аустенит+ледебурит, эвтектических – ледебурит и заэвтектических – цементит (первичный)+ледебурит.
Превращения, происходящие в твердом состоянии, называются вторичной кристаллизацией. Они связаны с переходом при охлаждении γ-железа в α-железо и распадом аустенита.
Линия GS соответствует температурам начала превращения аустенита в феррит. Ниже линии GS сплавы состоят из феррита и аустенита.
Линия ЕS показывает температуры начала выделения цементита из аустенита вследствие уменьшения растворимости углерода в аустените с понижением температуры. Цементит, выделяющийся из аустенита, называется вторичным цементитом.
В точке S при температуре 727°С и концентрации углерода в аустените 0,8 % образуется эвтектоидная смесь состоящая из феррита и цементита, которая называется перлитом. Перлит получается в результате одновременного выпадения из аустенита частиц феррита и цементита. Процесс превращения аустенита в перлит можно записать формулой А0,8П[Ф0,03+Ц6,67].
Линия PQ показывает на уменьшение растворимости углерода в феррите при охлаждении и выделении цементита, который называется третичным цементитом.
Следовательно, сплавы, содержащие менее 0,008% углерода (точкаQ), являются однофазными и имеют структуру чистого феррита, а сплавы, содержащие углерод от 0,008 до 0,03% – структуру феррит+цементит третичный и называются техническим железом.
Доэвтектоидные стали при температуре ниже 727ºС имеют структуру феррит+перлит и заэвтектоидные – перлит+цементит вторичный в виде сетки по границам зерен.
В доэвтектических чугунах в интервале температур 1147–727ºС при охлаждении из аустенита выделяется цементит вторичный, вследствие уменьшения растворимости углерода(линия ES). По достижении температуры 727ºС (линия PSK) аустенит, обедненный углеродом до 0,8% (точка S), превращаясь в перлит. Таким образом, после окончательного охлаждения структура доэвтектических чугунов состоит из перлита, цементита вторичного и ледебурита превращенного (перлит+цементит).
Структура эвтектических чугунов при температурах ниже 727ºС состоит из ледебурита превращенного. Заэвтектический чугун при температурах ниже 727ºС состоит из ледебурита превращенного и цементита первичного.
Правило фаз устанавливает зависимость между числом степеней свободы, числом компонентов и числом фаз и выражается уравнением:
C = K + 1 – Ф,
где С – число степеней свободы системы;
К – число компонентов, образующих систему;
1 – число внешних факторов (внешним фактором считаем только температуру, так как давление за исключением очень высокого мало влияет на фазовое равновесие сплавов в твердом и жидком состояниях);
Ф – число фаз, находящихся в равновесии.
Сплав железа с углеродом, содержащий 1,1 % С, называется заэвтектоидной сталью. Его структура при комнатной температуре – цементит (вторичный) + перлит.
а) б)
Рисунок 4: а – диаграмма железо-цементит, б – кривая охлаждения для сплава, содержащего 1,1% углерода
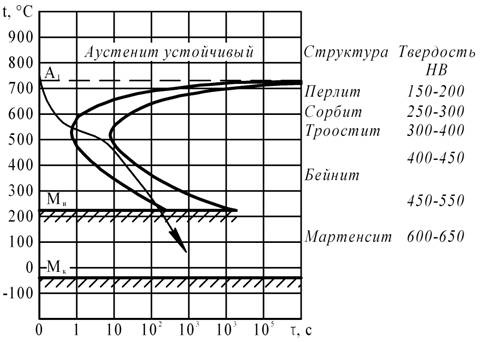
При непрерывном охлаждении стали У8 получена структура троостит + мартенсит. Нанесите на диаграмму изотермического превращения аустенита кривую охлаждения, обеспечивающую получение данной структуры. Укажите интервалы температур превращений и опишите характер превращения в каждом из них.
Для получения структуры троостит + мартенсит в стали У8 необходимо нагреть ее до температуры выше точки А1, затем охладить так, чтобы пересечь кривую начала превращения аустенита в перлит в области троостита и, минуя кривую конца превращения, перейти в область мартенсита.
При нагреве стали У8 выше А1 перлит переходит в аустенит. При охлаждении со скоростью ниже критической (см. рис.) образуется ферритно-цементитная структура – троостит и мартенсит.
В зависимости от соотношения содержаний троостита и мартенсита в троостомартенсите (от скорости охлаждения) твердость стали может меняться от 300 НВ (при 100 % троостита) до 650 НВ (при 100 % мартенсита).
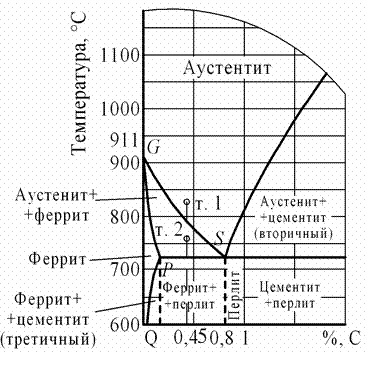
С помощью диаграммы железо-цементит, установите температуру полной и неполной закалки для стали 45 опишите структуру и свойства стали после каждого вида термической обработки.
Закалка доэвтектоидной стали заключается в нагреве стали до температуры выше критической (Ас3), в выдержке и последующем охлаждении со скоростью, превышающей критическую.
Температура точки Ас3 для стали 45 составляет 755°С.
Если доэвтектоидную сталь нагреть выше Ас1, но ниже Ас3 (неполная закалка), то в ее структуре после закалки наряду с мартенситом будут участки феррита. Присутствие феррита как мягкой составляющей снижает твердость стали после закалки. При нагреве до температуры 740°С (ниже точки Ас3) структура стали 45 – аустенит + феррит, после охлаждения со скоростью выше критической структура стали – мартенсит + феррит.
Доэвтектоидные стали для полной закалки следует нагревать до температуры на 30-50°С выше Ас3. Температура нагрева стали под полную закалку, таким образом, составляет 800-840°С. Структура стали 45 при температуре нагрева под закалку – аустенит, после охлаждения со скоростью выше критической – мартенсит.
Сплав в котором атомы растворенного элемента распределяются в решетке растворителя имеет структуру
21. Твердые растворы замещения и внедрения; промежуточные фазы; сверхструктуры
Твердые растворы – это фазы, в которых один из компонентов сплава сохраняет свою кристаллическую решетку, а атомы других компонентов располагаются в решетке первого компонента, изменяя ее размеры (периоды). Твердый раствор, который состоит из двух компонентов, имеет один тип решетки и представляет одну фазу.
Различают твердые растворы замещения и твердые растворы внедрения. При образовании твердого раствора замещения атомы растворенного компонента замещают часть атомов растворителя в его кристаллической решетке.
При кристаллизации чистого металла в системе имеются две фазы: жидкая (расплавленный металл) и твердая (зерна затвердевшего металла). В твердых сплавах фазы – это зерна чистого металла, зерна твердого раствора и зерна химического соединения.
Все металлы в жидком состоянии растворяются один в другом в любых соотношениях. В результате растворения образуется однородный жидкий раствор с равномерным распределением атомов одного металла среди атомов другого металла.
Некоторые металлы, сильно различающиеся размерами атомов, не растворяются в жидком состоянии, а немногие металлы растворяются в жидком состоянии ограниченно.
При образовании сплавов в процессе их затвердевания возможно различное взаимодействие компонентов.
Если в процессе кристаллизации сила взаимодействия между однородными атомами окажется больше силы взаимодействия между разнородными атомами, то после кристаллизации образуется механическая смесь, состоящая из зерен чистых металлов. В этом случае в твердом сплаве будут присутствовать зерна одного чистого металла и рядом с ними зерна другого чистого металла. Такая форма взаимодействия возникает при большом различии в свойствах входящих в сплав металлов.
Другой формой взаимодействия между веществами, входящими в состав сплава, является образование твердых растворов.
Твердыми растворами называют такие твердые фазы, в которых соотношения между компонентами могут изменяться. В твердом растворе так же, как и в чистых металлах, атомы в пространстве расположены закономерно, образуя кристаллическую решетку. Этим они и отличаются от жидких растворов. В твердом растворе одно из входящих в состав сплава веществ сохраняет присущую ему кристаллическую решетку, а второе вещество, утратив свое кристаллическое строение, в виде отдельных атомов распределяется в кристаллической решетке первого. Первое вещество является растворителем, а второе – растворимым. В зависимости от характера21б распределения атомов растворимого элемента различают твердые растворы внедрения, замещения и вычитания. Независимо от типа твердого раствора общим для них является то, что они однофазны и существуют в интервале концентраций. Для твердых растворов характерны металлические связи. В твердых растворах внедрения атомы растворимого элемента распределяются в кристаллической решетке металла-растворителя, занимая места между его атомами.
Ранее было отмечено, что у металлов атомы в кристаллической решетке располагаются близко один к другому и пустоты между ними имеют малые размеры. Разместиться в таких пустотах могут только атомы с очень малыми размерами.
Наименьшие размеры атомов имеют некоторые металлоиды – водород, азот, углерод, бор, которые и образуют с металлами твердые растворы внедрения. Но и у этих элементов размер атомов несколько превышает размер межатомных промежутков в кристаллической решетке металлов, поэтому при образовании твердых растворов внедрения решетка искажается и в ней возникают напряжения. При этом концентрация твердого раствора внедрения не может быть высокой: она редко превышает 1–2%.
В твердых растворах замещения атомы растворимого элемента занимают места атомов основного металла. Посторонние атомы могут замещать атомы растворителя в любых местах, поэтому такие растворы называют неупорядоченными твердыми растворами. Размеры атомов растворимого элемента отличаются от размеров атома растворителя (они больше или меньше), поэтому при образовании твердого раствора замещения кристаллическая решетка металла-растворителя немного искажается, не утрачивая при этом своего основного строения.
Твердые растворы замещения могут быть ограниченными и неограниченными. Одно из условий неограниченной растворимости – размерный фактор: чем больше различие в атомных радиусах, тем меньше растворимость.
С понижением температуры в твердых растворах замещения может произойти процесс перераспределения атомов, а результате которого атомы растворенного элемента займут строго определенные места в решетке растворителя. Такие твердые растворы называют упорядоченными твердыми растворами, а их структуру – сверхструктурой.
Температуру перехода неупорядоченного состояния в упорядоченное называют точкой Курнакова. Упорядоченные твердые растворы характеризуются большей твердостью, меньшей пластичностью и электросопротивлением. Их можно рассматривать как промежуточные фазы между твердыми растворами и химическими соединениями.
Сплав в котором атомы растворенного элемента распределяются в решетке растворителя имеет структуру
12. Фазовые превращения в твердом состоянии
Фаза – это однородная часть системы, которая отделена от другой части системы (фазы) поверхностью раздела, при переходе через которую химический состав или структура изменяются скачком.
При кристаллизации чистого металла в системе имеются две фазы: жидкая (расплавленный металл) и твердая (зерна затвердевшего металла). В твердых сплавах фазами могут быть зерна чистого металла, зерна твердого раствора и зерна химического соединения. Многие металлы в жидком состоянии растворяются один в другом в любых соотношениях. В результате растворения образуется однородный жидкий раствор с равномерным распределением атомов одного металла среди атомов другого металла. Благодаря указанному взаимодействию на практике с целью равномерного распределения веществ в сплаве, прибегают к их расплавлению. Некоторые металлы, сильно различающиеся размерами атомов, не растворяются в жидком состоянии, а другие металлы растворяются в жидком состоянии ограниченно. При образовании сплавов в процессе их затвердевания возможно различное взаимодействие компонентов.
Если в процессе кристаллизации сила взаимодействия между однородными атомами больше силы взаимодействия между разнородными атомами, то после кристаллизации образуется механическая смесь, состоящая из зерен чистых металлов. В этом случае в твердом сплаве будут присутствовать зерна одного чистого металла и рядом с ними зерна другого чистого металла. Такая форма взаимодействия возникает при большом различии в свойствах входящих в сплав металлов.
Другой формой взаимодействия между веществами, входящими в состав сплава, является образование твердых растворов.
Твердые растворы – это твердые фазы, в которых соотношения между компонентами могут изменяться. В твердом растворе так же, как и в чистых металлах, атомы в пространстве расположены закономерно и образуют кристаллическую решетку. Этим они и отличаются от жидких растворов. В твердом растворе одно из входящих в состав сплава веществ сохраняет присущую ему кристаллическую решетку, а второе вещество, которое утратило свое кристаллическое строение, в виде отдельных атомов распределяется в кристаллической решетке первого. Первое вещество является растворителем, а второе – растворимым. В зависимости от характера распределения атомов растворимого элемента различают твердые растворы внедрения, замещения и вычитания; независимо от типа твердого раствора общим для них является то, что они однофазны и существуют в интервале концентраций. Для твердых растворов характерен металлический тип связи.
Наименьшие размеры атомов имеют некоторые металлоиды – водород, азот, углерод, бор, которые образуют с металлами твердые растворы внедрения. Но и у этих элементов размер атомов несколько превышает 12б размер межатомных промежутков в кристаллической решетке металлов, поэтому при образовании твердых растворов внедрения решетка искажается и в ней возникают напряжения. При этом концентрация твердого раствора внедрения не может быть высокой. Она редко превышает 1–2%. В твердых растворах замещения атомы растворимого элемента занимают места атомов основного металла. Посторонние атомы могут замещать атомы растворителя в любых местах, поэтому такие растворы называют неупорядоченными твердыми растворами. Размеры атомов растворимого элемента всегда отличаются от размеров атома растворителя (они больше или меньше), поэтому при образовании твердого раствора замещения кристаллическая решетка металлара-створителя искажается, не утрачивая при этом своего основного строения. Твердые растворы замещения могут быть ограниченными и неограниченными. Одно из условий неограниченной растворимости – размерный фактор. Чем больше различие в атомных радиусах, тем меньше растворимость.
С понижением температуры в твердых растворах замещения происходит процесс перераспределения атомов, в результате которого атомы растворенного элемента займут строго определенные места в решетке растворителя. Такие твердые растворы называют упорядоченными твердыми растворами, а их структуру – сверхструктурой.
Некоторые элементы видоизменяют свое кристаллическое строение в зависимости от изменения внешних условий – температуры и давления. В твердом состоянии литий, молибден имеют объемно-центрированную кубическую решетку; алюминий, серебро, золото, платина – гранецентрированную, а магний, цирконий – гексагональную. При изменении температуры может оказаться, что для того же металла более устойчивой будет другая решетка, чем та, которая была при другой температуре. Это явление носит название полиморфизма. Каждый вид решетки представляет аллотропическое видоизменение или модификацию. При полиморфных превращениях металлов основное значение имеет температура. Превращение одной аллотропической формы в другую происходит при постоянной температуре, называемой температурой полиморфного превращения и сопровождается тепловым эффектом, подобно явлениям плавление-затвердевание или испарение-конденсация. Это связано с необходимостью затраты определенной энергии на перестройку кристаллической решетки.
Классификация сплавов твердых растворов
По степеням растворимости компонентов различают твердые растворы:
• с неограниченной растворимостью компонентов;
• с ограниченной растворимостью компонентов.
При неограниченной растворимости компонентов кристаллическая решетка компонента растворителя по мере увеличения концентрации растворенного компонента плавно переходит в кристаллическую решетку растворенного компонента.
Для образования растворов с неограниченной растворимостью необходимы:
1) изоморфность (однотипность) кристаллических решеток компонентов;
2) близость атомных радиусов компонентов, которые не должны отличаться более чем на 8. 13 %;
3) близость физико-химических свойств подобных по строению валентных оболочек атомов.
При ограниченной растворимости компонентов возможна концентрация растворенного вещества до определенного предела. При дальнейшем увеличении концентрации однородный твердый раствор распадается с образованием двухфазной смеси.
По характеру распределения атомов растворенного вещества в кристаллической решетке растворителя различают твердые растворы:
В растворах замещения в кристаллической решетке растворителя часть его атомов замещена атомами растворенного элемента (рис.2.4а). Замещение осуществляется в случайных местах, поэтому такие растворы называют неупорядоченными твердыми растворами.
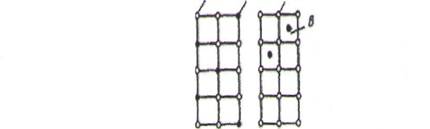 а) б) | Рис. 2.4. Кристаллическая решетка твердых растворов замещения (а) и внедрения (б) |
Твердые растворы внедрения образуются внедрением атомов растворенного компонента в поры кристаллической решетки растворителя (рис.2.4б).
Образование таких растворов возможно, если атомы растворенного элемента имеют малые размеры. Такими являются элементы, находящиеся в начале Периодической системы Менделеева: углерод, водород, азот, бор. Размеры атомов превышают размеры межатомных промежутков в кристаллической решетке металла, это вызывает искажение решетки и в ней возникают напряжения. Концентрация таких растворов не превышает 2-2.5%
Твердые растворы вычитания, или растворы с дефектной решеткой, образуются на базе химических соединений, при этом возможна не только замена одних атомов в узлах кристаллической решетки другими, но и образование пустых, не занятых атомами узлов в решетке. К химическому соединению добавляют один из входящих в формулу элементов, его атомы занимают нормальное положение в решетке соединения, а места атомов другого элемента остаются незанятыми.
Читайте также:


