Как называется сплав в котором содержится большое количество ртути
Кыся гуру --> 2 года назад
В СССР ртуть было легко достать. Уж не знаю, как, но встречал я ее часто. Например, в КЮМе у нас была целая литровая банка. Нахренам - никому не ведомо. Мы ее даже в рот набирали. Выплевывали, конечно, но частицы наверняка проглатывали. Но никто не помер. Всех поражал ее вес, поднять эту банку было совсем не просто.
Сейчас от разбитого градусника кипеж поднимают, но она совсем не так опасна. Опасны, наверное, ее соли.
Ответить • Ссылка • Пожаловаться •
wilddewill гуру --> Кыся 2 года назад
У меня ртутная капля "жила" в банке с водой где то пол года. Потом она просто превратилась в какой то шлак, напоминающий окислы алюминия.
Ответить • Ссылка • Пожаловаться •
Snork Snorkoff гуру --> Кыся 2 года назад
В школе как с оценками было? С зубами всё нормально? Почки?
Ответить • Ссылка • Пожаловаться •
Нестерин Сергей гуру --> Snork Snorkoff 2 года назад
И с зубами и с почками и прочим организмом. Пары ртути- яд. Насколько быстрый- зависит от концентрации. Соединения паров ртути и некоторых в-в тоже представляют опасность. А чистая. у нас один мелкий в д/саду "дозебрился" до термометра(как, х/з), и скушал ртутный кончик. Медики переполошились, как бы внутренних микротравм от стекла не было! Нифига; в час икс засел на горшок и эту капельку вместе с тщательно разжёваным стеклом " выложил "- факир малолетний.
Ответить • Ссылка • Пожаловаться •
Snork Snorkoff гуру --> Нестерин Сергей 2 года назад
Вы Кыся??
У меня перед глазами просто пример живет, папа домой литровую банку ртути приволок с работы. Не померла, но..
Применение амальгам:
Авторы: Козловский М.Т., Зебрева А.И., Гладышев В.П.
Источник: Амальгамы и их применение. Козловский М.Т., Зебрева А.И., Гладышев В.П. 1971 год
Дата в источнике: 1971г
а м а л ь г а м а
• ж. химич. спуск, соединение, сплав других металлов с ртутью, сортучка. Серебряная сортучка находится в природе в виде руды; золотую делают для пополоты через огонь. Амальгамный, сортучковой, спусковой. Амальгамическое золото, серебро, спущенное со ртутью. Амальгамировать что, с чем, спускать с ртутью, сортучивать. Амальгамировка, амальгамация ж. действ. по глаг.; самая сортучка; добыча золота и серебра из руд посредством спуска со ртутью, которую после отгоняют огнем
Содержание
Содержание
Амальгама в стоматологии
- функции компонентов амальгамного сплава
- помещение для работы
Определение
Амальгамы - сплавы металлов с ртутью.
Амальгамы - промежуточные продукты при извлечении желтый металл и других благородных металлов из руд и концентратов.
Амальгама — жидкие или твёрдые сплавы ртути с другими металлами. Также амальгама может быть раствором ведущих себя аналогично металлам ионных комплексов (например, аммония).
Амальгама — профессиональное название одного из пломбировочных материалов, в свойствах которого используется способность ртути растворять некоторые металлы.
Амальгамой называется сплав одного или более металлов с ртутью.
Амальгамы — так называются соединения (сплавы) ртути с другими металлами; отсюда — амальгамировать, соединять со ртутью, покрывать (с поверхности) металлические предметы ртутью.
Амальгама является смесью ртути и других металлов. При комнатной температуре, ртуть является жидкостью и легко вступает в реакцию с такими металлами, как серебро, олово и медь, в процессе чего образуются твердые материалы.

Свойства
В зависимости от соотношения компонентов, природы металла и температуры представляют собой гомогенные системы (жидкие или твердые растворы, твердые интерметаллиды) или гетерогенные.
Растворимость (ат. %) металлов в ртути при 250 С составляет: In-70,3, Tl-43,7, Cd-10,1, Zn-6,4, Pb-1,9, Bi-1,6, Sn-1,2, Ga-3,6 Mg-3,0, Au-0,13, Ag-0,078, Al-1,5*10-2, Mn-3,7*10-3, Cu-7,4*10-3, Ni-1,5*10-5, Ti-2,1*10-5, Zr-2,3*10-6, Co-1,1*10-7, Fe-1,0*10-7, Pt-3,1*10-7.
Эвтектика Hg-Tl (8,55 ат. % Tl) с температурой плавления -59°С - наиболее легкоплавкий металлический сплав. При нанесении ртути на поверхность заметно растворимых в ней металлов и платины образуется смачивающая пленка жидкой амальгама; этот процесс называется амальгамированием.
Твердые интерметаллиды (иногда называются меркуридами) образуются в большинстве изученных систем металл - ртуть.
Так, с Mg ртуть образует MgHg2, MgHg, Mg5Hg3, Mg2Hg, Mg5Hg2, Mg3Hg. Tемператуpa плавления меркуридов выше, чем у ртути, а иногда даже выше, чем у второго компонента. Например, для LiHg она составляет 596 °С. Не образуют меркуридов, например, Zn, Al, Ga, Pb, Bi, Sb.
При нагревании амальгама ртуть испаряется. Из амальгамов металлов с высокой температурой кипения ртуть можно удалить нагреванием практически полностью. Т.к. растворенный металл в жидкой амальгаме измельчается до атомного состояния и на поверхности сплава не образуется плотная оксидная пленка металла, большинство амальгамов химически очень активно. Так, алюминий в амальгаме, в отличие от компактного металла, быстро реагирует с О2 воздуха при комнатной температуре.
Амальгамы низкоплавких металлов (Ga, In, Tl, Sn, Cd и др.) легко образуются при их нагревании с ртутью. Щелочные металлы взаимодействуют с Hg со значительным выделением тепла, поэтому при получении амальгамов их добавляют к ртути небольшими порциями. Золото, на поверхности которого отсутствует оксидная пленка, при соприкосновении с ртутью мгновенно образует амальгаму, которую можно удалить действием HNO3.
При нагревании амальгам купрума, серебра, золота и др. отгоняется ртуть. Железо не образует амальгамы, поэтому ртуть можно перевозить в стальных сосудах.
Получение
Амальгама (Amalgams) - это
Образованию амальгамов большинства металлов препятствует оксидная пленка на их поверхности. Поэтому для приготовления амальгама часто используют электрохимическое выделение металла на ртутном катоде, снятие защитной пленки с помощью различных реагентов, реакции вытеснения металлами ртути из растворов ее солей и др.
Так, амальгам алюминия образуется при действии обработанного соляной кислотой А1 на раствор Hg(NO3)2.
Физические свойства
Нахождение в природе
Ртуть является одним из наиболее чувствительных индикаторов скрытого оруденения не только ртутных, но и различных сульфидных месторождений, поэтому ореолы ртути обычно выявляются над всеми скрытыми сульфидными залежами и вдоль дорудных разрывных нарушений. Эта особенность, а также незначительное содержание ртути в породах, объясняются высокой упругостью паров ртути, возрастающей с увеличением температуры и определяющей высокую миграцию этого элемента в газовой фазе.
В поверхностных условиях киноварь и металлическая ртуть растворимы в воде даже при отсутствии сильных окислителей, но при их наличии (Fe2(SO4)3, озон, перекись водорода) растворимость этих минералов достигает десятков мг/л. Особенно хорошо растворяется ртуть в сульфидах едких щелочей с образованием, например, комплекса HgS • nNa2S. Ртуть легко сорбируется глинами, гидроокислами железа и марганца, глинистыми сланцами и углями [3] .
Месторождения
Ртуть считается редким металлом.
Известны месторождения ртути в Закавказье (Дагестан, Армения), Таджикистане, Словении, Киргизии, Украине (Горловка, Никитовский ртутный комбинат).
ртуть
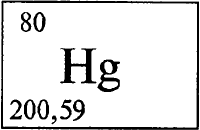
Природная ртуть состоит из смеси семи стабильных нуклидов: 196 Hg (содержание 0,146% по массе), 198 Hg (10,02%), 199 Hg (16,84%), 200 Hg (23,13%), 201 Hg (13,22%), 202 Hg (29,80%) и 204 Hg (6,85%). Радиус атома ртути 0,155 нм. Радиус иона Hg + — 0,111 нм (координационное число 3), 0,133 нм (координационное число 6), иона Hg 2+ — 0,083 нм (координационное число 2), 0,110 нм (координационное число 4), 0,116 нм (координационное число 6) или 0,128 нм (координационное число 8). Энергии последовательной ионизации нейтрального атома ртути равны 10,438, 18,756 и 34,2 эВ. Расположена во IIВ группе, 6 периода периодической системы. Конфигурация внешнего и предвнешнего электронных слоев 5s 2 p 6 d 10 6s 2 . В соединениях проявляет степени окисления +1 и +2. Электроотрицательность по Полингу (см. ПОЛИНГ Лайнус) 1,9.
История открытия
Ртуть известна человечеству с древнейших времен. Обжиг киновари (см. КИНОВАРЬ) HgS, приводящий к получению жидкой ртути, использовали еще в 5 в. до н. э. в Междуречье (см. МЕСОПОТАМИЯ) . Использование киновари и жидкой ртути описано в древних документах Китая, Ближнего Востока. Первое подробное описание получения ртути из киновари описано Теофрастом (см. ТЕОФРАСТ) около 300 лет до н. э.
В древности ртуть использовали для добычи золота (см. ЗОЛОТО (химический элемент)) из золотых руд. Этот способ основан на ее способности растворять многие металлы, образуя жидкие или легкоплавкие амальгамы (см. АМАЛЬГАМА) . При прокаливании амальгамы золота летучая ртуть испаряется, золото остается. Во второй половине 15 в в Мексике применяли амальгамирование для извлечения из руды серебра (см. СЕРЕБРО) .
Алхимики считали ртуть составной частью всех металлов, полагая, что изменением ее содержания можно осуществить превращение ртути в золото. Только в 20 в. физики установили, что в процессе ядерной реакции атомы ртути действительно превращаются в атомы золота. Но такой способ чрезвычайно дорог.
Жидкая ртуть — очень подвижная жидкость. Алхимики называли ртуть «меркурием» по имени римского бога Меркурия, славившегося своей быстротой в перемещении. В английском, французском, испанском и итальянском языках для ртути используется название «mercury». Современное латинское название происходит от греческих слов «хюдор» — вода и «аргирос» — серебро, т. е. «жидкое серебро».
Ртутные препараты использовали в медицине в средние века (ятрохимия (см. ЯТРОХИМИЯ) ).
Нахождение в природе
Редкий рассеянный элемент. Содержание ртути в земной коре 7,0·10 –6 % по массе. В природе ртуть встречается в свободном состоянии. Образует более 30 минералов. Основной рудный минерал киноварь. Минералы ртути в виде изоморфных примесей встречаются в кварце, халцедоне, карбонатах, слюдах, свинцово-цинковых рудах. Желтая модификация HgO встречается в природе в виде минерала монтроидита. В обменных процессах литосферы, гидросферы, атмосферы участвует большое количество ртути. Содержание ртути в рудах от 0,05 до 6—7%.
Получение
Первоначально ртуть получали из киновари (см. КИНОВАРЬ) , помещая ее куски в вязанки хвороста и обжигая киноварь в кострах.
В настоящее время ртуть получают окислительно-восстановительным обжигом руд или концентратов при 700—800 о С в печах кипящего слоя, трубчатых или муфельных. Условно процесс может быть выражен:
HgS + O2 = Hg + SO2
Выход ртути при таком способе составляет около 80%. Более эффективен способ получения ртути путем нагревания руды с Fe (см. ЖЕЛЕЗО) и CaO:
HgS + Fe = Hg – + FeS,
4HgS + 4CaO = 4Hg – + 3CaS + CaSO4.
Особо чистую ртуть получают электрохимическим рафинированием на ртутном электроде. При этом содержание примесей составляет от 1·10 –6 до 1·10 –7 %.
Физические и химические свойства
Ртуть — серебристо-белый металл, в парах бесцветный. Единственный жидкий при комнатной температуре металл. Температура плавления –38,87°C, кипения 356,58°C. Плотность жидкой ртути при 20°C 13,5457 г/см 3 , твердой ртути при –38,9°C — 14,193 г/см 3 .
Твердая ртуть — бесцветные кристаллы октаэдрической формы, существующая в двух кристаллических модификациях. «Высокотемпературная» модификация обладает ромбоэдрической решеткой a-Hg, параметры ее элементарной ячейки (при 78 К) а= 0,29925 нм, угол b = 70,74 о . Низкотемпературная модификация b-Hg обладает тетрагональной решеткой (ниже 79К).
С использованием ртути голландский физик и химик Х.Камерлинг-Оннес (см. КАМЕРЛИНГ-ОННЕС Хейке) в 1911 впервые наблюдал явление сверхпроводимости (см. СВЕРХПРОВОДИМОСТЬ) . Температура перехода a-Hg в сверхпроводящее состояние 4,153К, b-Hg — 3,949К. При более высоких температурах ртуть ведет себя как диамагнетик (см. ДИАМАГНЕТИК) . Жидкая ртуть не смачивает стекло и практически не растворяется в воде (в 100 г воды при 25°C растворяется 6·10 –6 г ртути).
Стандартный электродный потенциал пары Hg 2+ 2/Hg 0 = +0.789 B, пары Hg 2+ /Hg 0 = +0.854B, пары Hg 2+ /Hg 2+ 2= +0.920B. В неокисляющих кислотах ртуть не растворяется с выделением водорода (см. ВОДОРОД) . (см. КИСЛОРОД)
Кислород (см. КИСЛОРОД) и сухой воздух при обычных условиях ртуть не окисляют. Влажный воздух и кислород при ультрафиолетовом облучении или электронной бомбардировке окисляют ртуть с поверхности с образованием оксидов.
Ртуть окисляется кислородом воздуха при температуре выше 300°C, образуя оксид ртути HgO красного цвета:
2Hg + O2 = 2HgO.
Выше 340°C этот оксид разлагается на простые вещества.
При комнатной температуре ртуть окисляется озоном (см. ОЗОН) .
Ртуть не реагирует при нормальных условиях с молекулярным водородом, но с атомарным водородом образует газообразный гидрид HgH. Ртуть не взаимодействует с азотом, фосфором, мышьяком, углеродом, кремнием, бором, германием.
С разбавленными кислотами ртуть не реагирует, но растворяется в царской водке (см. ЦАРСКАЯ ВОДКА) и в азотной кислоте. Причем, в случае с кислотой продукт реакции зависит от концентрации кислоты и соотношения ртути и кислоты. При избытке ртути, на холоду, протекает реакция:
6Hg + 8HNO3 разбавл. = 3Hg2(NO3)2 + 2NO + 4H2O.
При избытке кислоты:
3Hg + 8HNO3 = 3Hg(NO3)2 + 2NO + 4H2O.
С галогенами (см. ГАЛОГЕНЫ) ртуть активно взаимодействует с образованием галогенидов (см. ГАЛОГЕНИДЫ) . При реакциях ртути с серой (см. СЕРА) , селеном (см. СЕЛЕН) и теллуром (см. ТЕЛЛУР) возникают халькогениды (см. ХАЛЬКОГЕНИДЫ) HgS, HgSe, HgTe. Эти халькогениды праrтически не растворимы в воде. Например, значение ПР HgS = 2·10 –52 . Сульфид ртути растворяется только в кипящей HCl, царской водке (при этом образуется комплекс [HgCl4] 2– ) и в концентрированных растворах сульфидов щелочных металлов:
HgS + K2S = K2[HgS2].
Сплавы ртути с металлами называют амальгамами (см. АМАЛЬГАМА) . Стойкие к амальгамированию металлы — железо (см. ЖЕЛЕЗО) , ванадий (см. ВАНАДИЙ) , молибден (см. МОЛИБДЕН) , вольфрам (см. ВОЛЬФРАМ) , ниобий (см. НИОБИЙ) и тантал (см. ТАНТАЛ (химический элемент)) . Со многими металлами ртуть образует интерметаллические соединения меркуриды.
Ртуть образует два оксида: оксид ртути(II) HgO и неустойчивый на свету и при нагревании оксид ртути(I) Hg2O (черные кристаллы).
HgO образует две модификации — желтую и красную, отличающиеся размерами кристаллов. Красная модификация образуется при добавлении к раствору соли Hg 2+ щелочи:
Hg(NO3)2 + 2NaOH = HgOЇ + 2NaNO3 + H2O.
Желтая форма химически более активна, при нагревании краснеет. Красная форма при нагревании чернеет, но приобретает прежний цвет при охлаждении.
При добавлении щелочи к раствору соли ртути(I) образуется оксид ртути (I) Hg2O:
Hg2(NO3)2 + 2NaOH = Hg2O + H2O + 2NaNO3.
На свету Hg2O распадается на ртуть и HgO, давая осадок черного цвета.
Для соединений ртути(II) характерно образование устойчивых комплексных соединений (см. КОМПЛЕКСНЫЕ СОЕДИНЕНИЯ) :
2KI + HgI2 = K2[HgI4],
2KCN + Hg(CN)2 = K2[Hg(CN)4].
Соли ртути(I) содержат группировку Hg2 2+ со связью –Hg–Hg–. Получают эти соединения, восстанавливая соли ртути(II) ртутью:
HgSO4 + Hg + 2NaCl = Hg2Cl2 + Na2SO4,
HgCl2 + Hg = Hg2Cl2.
В зависимости от условий, соединения ртути(I) могут проявлять как окислительные, так и восстановительные свойства:
Hg2Cl2 + Cl2 = 2HgCl2,
Hg2Cl2 + SnCl2 = 2Hg + SnCl4. (см. ПЕРОКСИДНЫЕ СОЕДИНЕНИЯ)
Пероксид (см. ПЕРОКСИДНЫЕ СОЕДИНЕНИЯ) HgO2 — кристаллы; неустойчив, взрывается при нагревании и ударе.
Применение
Ртуть используют для изготовления катодов при электрохимическом получении едких щелочей и хлора, а также для полярографов, в диффузионных насосах, барометрах и манометрах; для определения чистоты фтора и его концентрации в газах. Парами ртути наполняют колбы газоразрядных ламп (ртутных и люминесцентных) и источников УФ излучения. Ртуть применяют при нанесении золотых покрытий и при добычи золота из руды. (см. РТУТИ ХЛОРИДЫ)
Сулема (см. РТУТИ ХЛОРИДЫ) — важнейший антисептик, применяют при разбавлениях 1:1000. Оксид ртути (II), киноварь HgS применяются для лечения глазных и кожных и венерических заболеваний. Киноварь также используют для приготовления чернил и красок. В древности из киновари готовили румяна. Каломель (см. КАЛОМЕЛЬ) используется в ветеринарии в качестве слабительного средства.
Физиологическое действие
Ртуть и ее соединения высокотоксичны. Пары и соединения ртути накапливаясь в организме человека, сорбируются легкими, попадают в кровь, нарушают обмен веществ и поражают нервную систему. Признаки ртутного отравления проявляются уже при содержании ртути в концентрации 0.0002–0.0003 мг/л. Пары ртути фитотоксичны, ускоряют старение растений.
При работе с ртутью и ее соединениями следует предотвращать ее попадание в организм через дыхательные пути и кожу. Хранят в закрытых сосудах.
Энциклопедический словарь . 2009 .
Синонимы:Полезное
Смотреть что такое "ртуть" в других словарях:
ртуть — ртуть, и … Русский орфографический словарь
ртуть — ртуть/ … Морфемно-орфографический словарь
РТУТЬ — (лат. Hydrargyrum) Hg, химический элемент II группы периодической системы, атомный номер 80, атомная масса 200,59. Серебристый жидкий металл (отсюда латинское название; от греч. hydor вода и argyros серебро). Плотность 13,5 г/м² (тяжелее всех … Большой Энциклопедический словарь
РТУТЬ — (Hydrargyrum), Hg, химический элемент II группы периодической системы, атомный номер 80, атомная масса 200,59; единственный из металлов жидкий при комнатной температуре, температура плавления 38,87 шC, температура кипения 356,58 шC, очень летуча … Современная энциклопедия
История
Вы поможете проекту, исправив и дополнив его.
Происхождение названия
Токсикология ртути
Основная статья: Отравление ртутью- Органические соединения ртути (метилртуть и др.) в целом намного более токсичны, чем неорганические, прежде всего из-за их липофильности и способности более эффективно взаимодействовать с элементами ферментативных систем организма.
Гигиеническое нормирование концентраций ртути
Демеркуризация
Основная статья: Демеркуризация(Amalgams)
Получение
Вы поможете проекту, исправив и дополнив его.Ртуть получают обжигом киновари (cульфида ртути(II)): Уравнение реакции:

Тяжёлая жидкость серебристо-белого цвета
Ртуть / Hydrargyrum (Hg), 80
[Xe] 4f 14 5d 10 6s 2
2,00 (шкала Полинга)
HgОпределение амальгамы, получение и применение, функции амальгамы
Информация об амальгаме, получение и применение амальгамы, состав и функции сплава
Применение ртути и её соединений
Медицина
В связи с высокой токсичностью ртуть почти полностью вытеснена из медицинских препаратов. Её соединения (в частности, мертиолят) используется как консервант для вакцин. [9] . Сама ртуть сохраняется в медицинских термометрах (один медицинский термометр содержит до 2 г ртути).
Однако вплоть до 1970-х годов соединения ртути использовались в медицине очень активно [10] :
Амальгаму серебра применяют в стоматологии в качестве материала зубных пломб.
Ртуть-203 (T1/2 = 53 сек) используется в радиофармакологии.
Техника
- Ртуть используется как рабочее тело в ртутных термометрах (особенно высокоточных), так как (а) обладает довольно широким диапазоном, в котором находится в жидком состоянии, (б) её коэффициент термического расширения почти не зависит от температуры и (в) обладает сравнительно малой теплоёмкостью. Сплав ртути с таллием используется для низкотемпературных термометров.
- Парами ртути заполняют люминесцентные лампы, поскольку пары светятся в тлеющем разряде. В спектре испускания паров ртути много ультрафиолетового света и чтобы преобразовать его в видимый, стекло люминесцентных ламп изнутри покрывают люминофором. Без люминофора ртутные лампы являются источником жесткого ультрафиолета (254 нм), в каковом качестве и используются. Такие лампы делают из кварцевого стекла, пропускающего ультрафиолет, поэтому они называются кварцевыми.
- Ртуть и сплавы на её основе используются в герметичных выключателях, включающихся при определённом положении.
- Ртуть используется в датчиках положения.
- В некоторых химических источниках тока (например, ртутно-цинковых), в эталонных источниках напряжения (Нормальный элемент Вестона).
- Ртуть также иногда применяется в качестве рабочего тела в тяжелонагруженных гидродинамических подшипниках[11] .
- Ртуть ранее входила в состав некоторых биоцидных красок для предотвращения обрастания корпуса судов в морской воде. Сейчас запрещается использовать такого типа покрытия. используется как полупроводниковый детектор радиоактивного излучения. («Гремучая ртуть») издавна применяется в качестве инициирующего ВВ (Детонаторы). применяется при термохимическом разложении воды на водород и кислород (атомно-водородная энергетика).
- Перспективно использование ртути в сплавах с цезием в качестве высокоэффективного рабочего тела в ионных двигателях.
- До середины 20 века ртуть широко применялась в барометрах и манометрах.
- Ртутные вакуумные насосы были основными источниками вакуума в 19 и начале 20 веков.
- Ранее ртуть использовали для золочения поверхностей методом амальгамирования, однако в настоящее время от этого метода отказались из-за токсичности ртути.
- Соединения ртути использовались в шляпном производстве для выделки фетра.
Металлургия
- Металлическая ртуть применяется для получения целого ряда важнейших сплавов.
- Ранее различные амальгамы металлов, особенно амальгамы золота и серебра, широко использовались в ювелирном деле, в производстве зеркал.
- Металлическая ртуть служит катодом для электролитического получения ряда активных металлов, хлора и щелочей. Сейчас вместо ртутных катодов используют электролиз с диафрагмой.
- Ртуть используется для переработки вторичного алюминия (см. амальгамация)
- Ртуть хорошо смачивает золото, поэтому ей обрабатывают золотоносные глины для выделения из них этого металла. Эта технология распространена, в частности, в Амазонии.
Химическая промышленность
- Соли ртути использовали в качестве катализатора промышленного получения ацетальдегида из ацетилена (реакция Кучерова), однако в настоящее время ацетальдегид получают прямым каталитическим окислением этана или этен. используется для количественного определения аммиака.
Сельское хозяйство
Высокотоксичные соединения ртути, такие как хлорид ртути(I) (каломель), хлорид ртути (II) (сулема), мертиолят и другие используют для протравливания семенного зерна и в качестве пестицидов.
Изотопы ртути
| Изотоп | 196 | 198 | 199 | 200 | 201 | 202 | 204 |
|---|---|---|---|---|---|---|---|
| Концентрация, (%) | 0,146 | 10,02 | 16,84 | 23,13 | 13,22 | 29,80 | 6,85 |
Сплав ртути с металлом
Википедия Значение слова в словаре Википедия
«Амальгама» — профессиональное название одного из пломбировочных материалов, в свойствах которого используется способность ртути растворять некоторые металлы (См. статью: Амальгама ). «Амальгама» является наиболее прочным пломбировочным материалом , который.
Толковый словарь живого великорусского языка, Даль Владимир Значение слова в словаре Толковый словарь живого великорусского языка, Даль Владимир
ж. химич. спуск, соединение, сплав других металлов с ртутью, сортучка. Серебряная сортучка находится в природе в виде руды; золотую делают для пополоты через огонь. Амальгамный, сортучковой, спусковой. Амальгамическое золото, серебро, спущенное со ртутью.
Энциклопедический словарь, 1998 г. Значение слова в словаре Энциклопедический словарь, 1998 г.
АМАЛЬГАМА (средневековое лат. amalgama - сплав) сплав ртути с др. металлом. Амальгаму применяют, напр., при золочении, в производстве зеркал, в цветной металлургии (амальгамация).
Примеры употребления слова амальгама в литературе.
Наконец из последней реторты сияющая амальгама полилась на металлическое блюдо.
Скажи, зачем узор такой был даден тебе всего лишь на день в краю озер, чья амальгама впрок хранит пространство?
Если когда-нибудь позабудешь сумму углов треугольника или площадь в заколдованном круге, вернись сюда: амальгама зеркала в ванной прячет сильно сдобренный милой кириллицей волапюк и совершенно секретную мысль о смерти.
Ложь, фальсификация, подделка, судебная амальгама приняли небывалые еще в истории размеры и, как показывает дело Кирова, непосредственно угрожают сталинскому режиму.
Но хотя сталинские сподручные старательно приклеивают его к троцкизму, амальгама эта целиком выдумана, по существу Бухарин чужд как троцкистско-зиновьевскому блоку, так, конечно, и сталинской политике.
Химические свойства
Характерные степени окисления
'*Гидроксид не получен, существуют только соответствующие соли
'**Гидроксид существует только в очень разбавленных (<10 −4 моль/л) растворах.




добавлении лигандов, стабилизирующих степень окисления ртути +2.
Из-за диспропорционирования ни оксид, ни гидроксид ртути (I) получить не удаётся.
На холоду ртуть +2 и металлическая ртуть, наоборот, конпропорционируют. Поэтому, в частности, при реакции нитрата ртути (II) со ртутью получается нитрат ртути (I):

В степени окисления +2 ртуть образует катионы Hg 2+ , которые очень легко гидролизуются. При этом гидроксид ртути Hg(OH)2 существует только в очень разбавленных (<10 −4 моль/л) растворах. В более концентрированных растворах он дегидратируется:

В очень концентрированной щелочи оксид ртути частично растворяется с образованием гидроксокомплекса:
![\mathsf<HgO + OH^- + H_2O \rightarrow [Hg(OH)_3]^-></p>
<p>](https://dic.academic.ru/dic.nsf/ruwiki/765f1e88310ec58c339cb457f88afc3a.jpg)
Ртуть в степени окисления +2 образует уникально прочные комплексы со многими лигандами, причём как жесткими, так и мягкими по теории ЖМКО. С иодом (-1), серой (-2) и углеродом она образует очень прочные ковалентные связи. По устойчивости связей металл-углерод ртути нет равных среди других металлов, поэтому получено огромное количество ртутьорганических соединений.
Свойства простого вещества [8]
![\mathsf<3Hg + 2HNO_3 + 12HCl \rightarrow 3H_2[HgCl_4] + 2NO\uparrow + 4H_2O></p>
<p>](https://dic.academic.ru/dic.nsf/ruwiki/1c84ee4deaa49e4f473e101cb067f8ac.jpg)

Также с трудом растворяется в серной кислоте при нагревании, с образованием сульфата ртути:

При растворении избытка ртути в азотной кислоте на холоде образуется нитрат Hg2(NO3)2.

и различными хлорсодержащими отбеливателями. Эти реакции используют для удаления металлической ртути.
Амальгамы
АМАЛЬГАМЫ, сплавы ртути с различными металлами. Многие металлы легко растворяются в ртути, образуя, смотря по количеству и по качеству растворенного металла, жидкие, тестообразные или твердые сплавы. Амальгамы золота и серебра тестообразны. Свойством амальгамы пользуются для извлечения благородных металлов из их руд. Тонко измельченные руды обрабатываются ртутью; образовавшаяся амальгама легко отделяется от мути, а затем нагреванием ртуть улетучивают, причем золото или серебро остаются. Некоторые амальгамы, совершенно твердые при обыкновенной температуре, становятся тестообразными от незначительного нагревания. Этим пользуются для пломбирования зубов. Золотая и серебряная амальгамы служат для золочения и серебрения «через огонь». Для приготовления золотой амальгамы в графитовом тигле накаливают докрасна золотые листочки и заливают нагретой ртутью в восьми- или девятикратном количестве по весу. Перемешивают все графитовым стержнем и, когда золото растворится, выливают в воду. Применять для золочения надо свежеприготовленную амальгаму. Для приготовления зеркал применяется оловянная амальгама из 23% олова и 77% ртути. Раскладывают на горизонтальной плоскости оловянную фольгу, наливают на нее немного ртути и растирают суконкой, затем наливают сверху ртуть слоем в несколько миллиметров; на нее надвигают со стороны стекло и надавливанием выжимают лишнюю ртуть.
В таком положении стекло должно оставаться продолжительное время. Амальгама для покрывания подушек электрических машин состоит из 50% ртути, 25% олова и 25% цинка. Ртуть нагревают в фарфоровой ступке, в нее понемногу всыпают стружки цинка и олова и растирают пестиком. Так же приготовляются амальгамы для пломбирования зубов и для анатомических препаратов.
Амальгама для пломб состоит из 22—26% кадмия и 78—74% ртути. От прибавления висмута и олова амальгама становится еще пластичнее при легком нагревании. Прибавление меди и свинца, вследствие ядовитости, недопустимо. Для пломбирования годится также амальгама из 39% серебра и 61% олова, нагретых со ртутью в фарфоровом тигельке. Избыток ртути выдавливается через кожу. Амальгама для анатомического препарирования имеет состав: 46% висмута, 30% свинца,16% олова, 8% ртути. При 60% висмута она еще достаточно жидка. Никель и железо в ртути не растворяются. Поэтому ртуть можно хранить в железных или никелевых сосудах.
В окружающей среде

Одно из тяжелейших загрязнений ртутью в истории случилось в японском городе Минамата в 1956 году, что привело к более чем трём тысячам жертв, которые либо умерли, либо сильно пострадали от болезни Минамата.
Применение


Амальгамы
Амальгама – это сплав, один из компонентов которого – ртуть. Амальгамы могут быть жидкими и твердыми. Компоненты амальгамы могут образовывать интерметаллические соединения – меркуриды. Золото (Au), серебро (Ag), олово (Sn) сплавляются с Hg легко медь (Cu) – только в мелкораздробленном состоянии или при нагревании, титан (Ti), цирконий (Zr), ниобий Nb), тантал (Ta), молибден (Mo), вольфрам (W), рений (Re) – не сплавляются. Щелочные и щелочноземельные металлы образуют с ртутью устойчивые меркуриды (например, Na2Hg, KHg, MgHg), кадмий (Cd) и свинец (Pb) – твердые растворы.
Меркуриды Cu, Ag, Au, Pt разлагаются ниже температуры плавления с выделением Hg. Многие амальгамы остаются в жидком состоянии в широком интервале температур, инертны по отношению к агрессивным средам, обладают хорошими теплофизическими свойствами.
Получение:
• Электролиз соли металла на ртутном катоде;
• Взаимодействие металла с о ртутью;
Содержание
Читайте также:


